Manganoxid (MnO2) Kemisk struktur, egenskaper och användningsområden
den manganoxid (MnO2) är en oorganisk kemisk förening bildad av elementmanganet med ett oxidationsnummer +4 och syre, vilket vid bildningen av oxider har ett oxidationsnummer av -2. Det är också känt av namnen på mangan (IV) oxid och mangananhydrid.
Det är en solid från mörkt till svart kaffe. Det är naturligt som mineralpirolusiten, svarta och kristalliserade bildande dendriter (grenade förlängningar). Det kan erhållas som en svart rest i reaktionen mellan etylen och kaliumpermanganat efter bildningen av glykol genom oxidationsverkan av kaliumpermanganat.

Det är mycket viktigt i glasindustrin på grund av dess karaktär av oxidationsmedel, eftersom det eliminerar den gröna färgen som kommer från järnföreningarna och omvandlar dem till järn.
index
- 1 Kemisk struktur
- 2 egenskaper
- 3 användningsområden
- 3.1 Som katalysator
- 4 Effekter på hälsan
- 5 referenser
Kemisk struktur
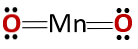
Den kemiska strukturen för föreningen motsvarar den för en anhydrid och inte den för en basoxid, vilket skulle förväntas eftersom den består av en metall och en icke-metall.
Detta speciella fall beror på beteendet som antas av mangan i de olika oxidationstillstånd som det har. Således bildar oxiderna MnO och Mn för oxidationstillstånden +2 och +32O3 respektive att de vid reaktion med vatten bildar respektive manganhydroxid och manganhydroxid.
Men Mn2O3 i ett lite surt medium uppför sig det som en anhydrid. Med oxidationstillstånden +4, +6 och +7, MnO2, MnO3 och MnO4 de bildar syror när de reagerar med vatten.
I ett något surt medium är MnO2 Det beter sig som en basoxid, så den kan bilda motsvarande hydroxid.

Man måste komma ihåg att i detta fall inte nämns amfotära egenskaper, enligt vilka en förening kan bete sig som en syra eller som en bas. Detta är ett speciellt fall av Mn-beteende.
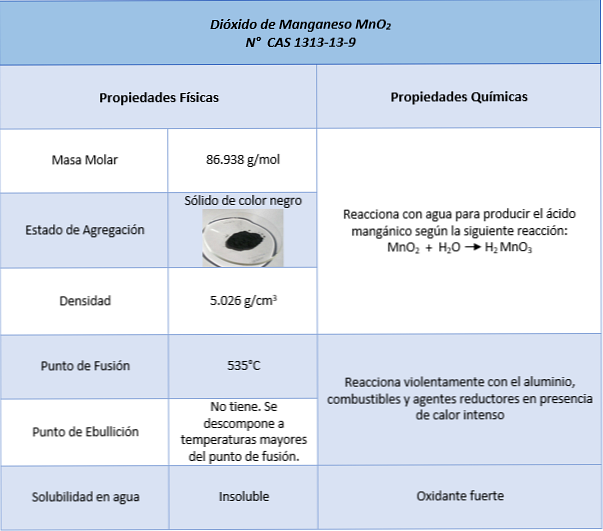
egenskaper
tillämpningar
- Det används som en källa till mangan
- Som oxidant i alkaliska batterier
- Färger för glas, keramik och porslin.
- Vid erhållande av klor och jod.
- Vid sönderdelning av väteperoxid för bildning av gasformig syre och vatten.
- I sönderdelningsreaktionen av kaliumklorat för framställning av gasformig syre och kaliumklorid.
- Löst i aceton eller i diklormetan, oxiderar primära alkoholer till aldehyder och sekundärt mot ketoner.
- Tillverkning av alkaliska batterier.
Som en katalysator
Detta gäller oxidreduktionsreaktioner, för avlägsnande av sulfider såsom H2S och katjoner som Fe+2 och Mn+2 , arsenik och radio som finns i grundvatten som är förorenade av denna typ av föreningar.
Denna förorening kan genereras antingen genom okontrollerad dumpning av giftiga material, genom tvättning av förorenad mark eller genom närvaro av kemiska element vid tidpunkten för utvinning av vatten.
MnO2 Hög renhet erhållen från pyrolusiten som används som filter (Filox) är det effektivaste sättet att avlägsna denna klass av föroreningar från grundvattnet.
Effekter på hälsan
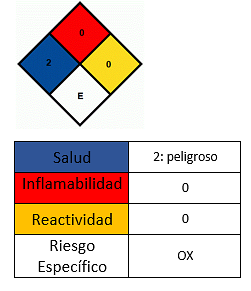
- Undvik kontakt med huden.
- Vid kontakt, tvätta motsvarande område.
- Inandning inte pulverna.
- Irritation och rodnad kan ses vid ögonkontakt. Tvätta med mycket vatten, låt vattnet springa genom ögonen och kontakta läkare om det är allvarligt.
- I kontakt med huden är irritation och rodnad observerad. Tvätta det drabbade området med mycket vatten och tvål.
- Förlängd hudkontakt avlägsnar ditt naturliga fett och utlöser dermatit.
- Inandning kan orsaka influensaliknande tillstånd (metalliska rök). Konditionen kännetecknas av hög feber, frossa, torr mun och hals, muskelsmärta och huvudvärk.
- Det kan irritera luftvägarna och öka förekomsten av andningsinfektioner (lunginflammation). Intoxikation genom absorption av oorganiska mangansalter genom lungorna är osannolikt, men kronisk förgiftning kan inträffa.
- Kronisk exponering för damm eller rök från mangandioxid under lång tid kan påverka centrala nervsystemet och leda till utvecklingen av Parkinsons sjukdom, vandringsvårigheter, muskelspasmer och beteendeförändringar.
- Förtäring kan orsaka buksmärta och illamående.
- Det är inte brandfarligt, men det bidrar till att sprida elden i glödlamporna. Om uppvärmd till en temperatur över 535 ° C sönderdelas ämnet till manganoxid (III) Mn2O3 och syre, vilket är brandfarligt och ökar risken för brand. I detta fall ska elden släckas med skum eller koldioxid.
- Vid spill, manipulera inte föreningen utan lämpligt personligt skydd.
- Förvara föreningen i tätt slutna behållare på kall och torr plats och borta från inkompatibla ämnen som organiskt material och brännbart material.
- Förvaringsplatsen måste vara torr och ha golv som är resistenta mot syrakorrosion och med bra dränering..
- Personlig skyddsutrustning ska användas, t.ex. handskar, skyddsglasögon, antimaskfiltermasker, damm och rök.
referenser
- B, (2015), Mangandioxid, Kungliga Kemiföreningen - Kemiska världen, hämtade från chemistryworld.com
- Karal, (2014), Mangnesondioxid, Säkerhetsdatablad, Återställt från, karal.com.mx
- Din virtuella lärare (2015/02/25). Manganorganiska föreningar (specialfall 1) - Teoretisk lektion), hämtad från youtube.com
- Ecured, (s.f), mangandioxid, återställd från ecured.cu
- Angarita G, Johnny., (2017), Mangandioxid: En exceptionell teknik. Hidroteco, återhämtat från hydrotecocr.com
- Fernández, G., (2015), MnO-mangandioxid2/ aceton, Organisk kemi, Återställd från quimicaorganica.net
- Tronox, (2011), Mangandioxid, Säkerhetsdatablad, Återställt från, Tronox.com


