Lithiumoxid formel, egenskaper, risker och användningar
den litiumoxid är en oorganisk kemisk förening med formel Li2Eller som bildas tillsammans med små mängder litiumperoxid när litiummetallen brinner i luften och kombineras med syre.
Tills 1990-talet var marknaden och litiummetall domineras av USA: s produktion från mineralfyndigheter, men i början av XXI århundradet delen av produktionen härleddes från icke-amerikanska källor; Australien, Chile och Portugal var de viktigaste leverantörerna i världen. Bolivia har hälften av litiumfyndigheterna i världen, men det är inte en stor producent.
Den viktigaste kommersiella formen är litiumkarbonat, Li2CO3, framställd av mineraler eller saltlösningar genom flera olika processer.
När litium brinner i luften är huvudprodukten den vita oxiden av litiumoxid, Li2O. Dessutom produceras lite litiumperoxid, Li2O2, även vit.
Det kan också göras genom termisk sönderdelning av litiumhydroxid, LiOH eller litiumperoxid, Li2O2
4Li (s) + O2(g) → 2Li2O (s)
2LiOH (s) + värme → Li2O (s) + H2O (g)
2Li2O2(er) + värme → 2Li2O (s) + O2(G)
Fysikaliska och kemiska egenskaper
Litiumoxid är ett vitt fastämne som kallas litia som saknar arom och en salt smak. Dess utseende visas i Figur 2 (National Center for Biotechnology Information, 2017).

Figur 2: Utseende av litiumoxid
Litiumoxid är kristaller med antifloritgeometri som liknar natriumklorid (kubikcentrerad på ansikten). Dess kristallina struktur presenteras i Figur 3 (Mark Winter [University of Sheffield och WebElements Ltd, 2016].
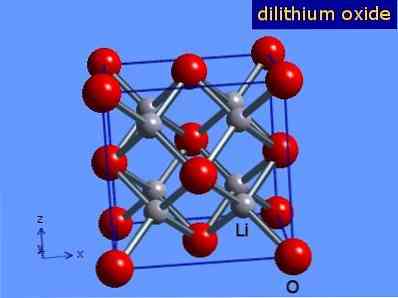
Figur 3: kristallin struktur av litiumoxid.
Dess molekylvikt är 29,88 g / mol, dens densitet är 2,013 g / ml och smält- och kokpunkten är 1438 ° C respektive 2066 ° C. Föreningen är väldigt löslig i vatten, alkohol, eter, pyridin och nitrobensen (Royal Society of Chemistry, 2015).
Litiumoxid reagerar lätt med vattenånga för att bilda hydroxid och med koldioxid för att bilda karbonat; Därför måste den lagras och hanteras i en ren och torr atmosfär.
Oxidföreningar leder inte till elektricitet. Vissa strukturerade oxider av perovskit är emellertid elektroniska ledare som hittar applicering i katoden av fastoxidbränsleceller och syregenereringssystem.
De är föreningar som innehåller minst en syreanjon och en metallkation (American Elements, S.F.).
Reaktivitet och faror
Litiumoxid är en stabil förening som är inkompatibel med starka syror, vatten och koldioxid. Enligt vår kännedom har litiumoxidens kemiska, fysikaliska och toxikologiska egenskaper inte undersökts och rapporterats djupt.
Litiumföreningarnas toxicitet är en funktion av deras löslighet i vatten. Litiumjon har toxicitet i centrala nervsystemet. Föreningen är mycket frätande irriterande om den kommer i kontakt med ögonen, huden, vid inandning eller inandning (ESPI METALS, 1993).
Vid kontakt med ögonen bör du kontrollera om du har kontaktlinser och omedelbart ta bort dem. Ögonen ska sköljas med rinnande vatten i minst 15 minuter och håller ögonlocken öppna. Du kan använda kallt vatten. Salva ska inte användas för ögonen.
Om kemikalien kommer i kontakt med kläder, ta bort det så snabbt som möjligt, skydda dina egna händer och kropp. Placera offret under en säkerhetsdusch.
Om den kemiska ackumuleras i exponerad hud av offret, såsom händer, tvättas försiktigt och omsorgsfullt förorenad hud med rinnande vatten och mild tvål. Du kan använda kallt vatten. Om irritation kvarstår, kontakta läkare. Tvätta förorenade kläder före återanvändning.
Vid inandning ska offret tillåtas vila i ett välventilerat område. Om inandningen är svår, ska offeret evakueras till ett säkert område så snart som möjligt.
Lossa snäva kläder som t-shirt, bälten eller slips. Om offeret finner det svårt att andas, ska syre administreras. Om offret inte andas utförs en munnen-till-mun-återupplivning.
Ta alltid hänsyn till att det kan vara farligt för personen som ger hjälp att ge munnen-till-mun-återupplivning när det inandade materialet är giftigt, infektiöst eller frätande.
I alla fall bör du söka omedelbar läkarvård (SIGMA-ALDRICH, 2010).
tillämpningar
Litiumoxid används som fluss i keramiska glasyrer, och skapar blå med koppar och rosor med kobolt. Litiumoxid reagerar med vatten och ånga, bildar litiumhydroxid och måste isoleras från dem.
Litiumoxid (Li2O) med sin höga tritiumpotential är en attraktiv kandidat för det fasta odlingsmaterialet i en DT-fusionskraftverk, på grund av dess höga densitet av litiumatomer (jämfört med andra litium- eller metalliska litiumkeramik) och dess konduktivitet relativt hög termisk (litiumoxid (Li2O), SF).
Li2Eller det kommer att utsättas för höga temperaturer under neutronbestrålning under drift av fusionsdukar. Under dessa omständigheter uppstår ett stort antal bestrålningsfel i Li2Eller, såsom svullnad inducerad av helium, med relativt hög värmeutvidgning, korntillväxt, bildning av LiOH (T) och utfällning vid låga temperaturer och masstransport av LiOH (T) vid höga temperaturer.
Dessutom har Li2Eller det kommer att bli föremål för stress som uppstår på grund av skillnader i termisk expansion mellan Li2O och strukturella material. Dessa egenskaper hos Li2Eller de leder till utmanande tekniska problem i både tillverkning och design av filt.
En möjlig ny användning är som ersättning för kobolt och litiumoxid som katod i litiumjonbatterier som används för att driva elektroniska enheter från mobiltelefoner till bärbara datorer samt batteridrivna bilar (Reade International Corp, 2016).
referenser
- Mark Winter [University of Sheffield and WebElements Ltd. (2016). webelements. Hämtad från litium: dilithiumoxid webelements.com.
- Amerikanska element. (S.F.). Litiumoxid. Hämtad från americanelements americanelements.com.
- ESPI-METALER. (1993, juni). Litiumoxid. Hämtad från espimetals espimetals.com.
- LITIUMOXID (Li2O). (S.F.). Hämtad från ferp.ucsd.edu ferp.ucsd.edu.
- National Center for Biotechnology Information. (2017, 24 juni). PubChem Compound Database; CID = 166630. Hämtad från PubChem pubchem.ncbi.nlm.nih.gov.
- Reade International Corp. (2016). Litiumoxidpulver (Li2O). Hämtad från reade reade.com
- Royal Society of Chemistry. (2015). Litiumoxid.Hämtad från chemspiderchemspider.com.
- Sigma-Aldrich. (2010). Säkerhetsdatablad Litiumoxid. Hämtad från chemblink chemblink.com.


