Silversulfid (Ag2S) struktur, egenskaper, nomenklatur, användningsområden
den silversulfid är en oorganisk förening vars kemiska formel är Ag2S. Den består av ett svartgråt fastämne som bildas av Ag katjoner+ och anjoner S2- i ett förhållande 2: 1. S2- det är mycket besläktat med Ag+, eftersom båda är mjuka joner och de lyckas stabilisera med varandra.
Silverprydnader tenderar att mörkas och förlorar sin karakteristiska glans. Färgförändringen är inte en produkt av oxidationen av silveret, men av dess reaktion med vätesulfiden närvarande i omgivningen vid låga koncentrationer; Detta kan härröra från ruttning eller nedbrytning av växter, djur eller mat rik på svavel.

H2S, vars molekyl bär en svavelatom, reagerar med silver enligt följande kemiska ekvation: 2Ag (s) + H2S (g) => Ag2S (s) + H2(G)
Därför är Ag2S är ansvarig för de svarta skikten som bildas på silver. I naturen kan denna svavel också hittas i acantita och argentita mineraler. De två mineralerna skiljer sig från många andra genom sina svarta och ljusa kristaller, som det fasta i den övre bilden.
Ag2S presenteras polymorfa strukturer, elektroniska egenskaper och attraktiv optoelektroniska, det är halvledare och lovar att vara material för framställning av fotoelektriska anordningar, såsom solceller.
index
- 1 struktur
- 2 egenskaper
- 2,1 Molekylvikt
- 2.2 Utseende
- 2.3 lukt
- 2.4 Smältpunkt
- 2,5 Löslighet
- 2.6 Struktur
- 2,7 brytningsindex
- 2,8 Dielektrisk konstant
- 2.9 Elektronik
- 2.10 Reduktionsreaktion
- 3 nomenklaturen
- 3.1 Systematik
- 3,2 lager
- 3,3 traditionell
- 4 användningsområden
- 5 referenser
struktur
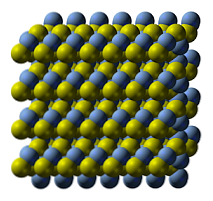
Den kristallina strukturen av silversulfid illustreras i den övre bilden. De blå sfärerna motsvarar Ag kationerna+, medan de gula till anjonerna S2-. Ag2S är polymorf, vilket innebär att det kan vidta flera kristallina system under vissa temperaturförhållanden.
Hur? Genom en fasövergång. Joner omarrangeras så att temperaturökningen och fast vibration inte stör den elektrostatiska attraktionen-repulsions balans. När detta händer sägs det att det finns en fasövergång, och det fasta materialet uppvisar därför nya fysikaliska egenskaper (såsom glans och färg).
Ag2S vid normala temperaturer (lägre än 179ºC), har den en monoklinisk kristallin struktur (a-Ag2S). Förutom denna fasta fas finns det två andra: bcc (kubikcentrerad i kroppen) mellan 179 till 586ºC och fcc (kubikcentrerad i ansikten) vid mycket höga temperaturer (δ-Ag2S).
Argentitmineralet består av fcc-fasen, även känd som β-Ag2S. När de har kylts och förvandlats till en klippa råder deras strukturella egenskaper samman. Därför existerar båda kristallstrukturerna: monokliniska och bcc. Därför framträder svarta fasta ämnen med ljusa och intressanta övertoner.
egenskaper
Molekylvikt
247,80 g / mol
utseende
Gråa svarta kristaller
lukt
toalett.
Smältpunkt
836ºC. Detta värde är förenligt med det faktum att Ag2S är en förening med liten jonisk karaktär och smälter därför vid temperaturer under 1000ºC.
löslighet
I vatten bara 6,21 ∙ 10-15 g / l vid 25 ° C. Det vill säga mängden av det svarta fasta ämnet som är solubiliserat är försumbar. Detta beror återigen på den lilla polära karaktären hos Ag-S-bindningen, där det inte finns någon signifikant skillnad av elektronegativitet mellan båda atomerna.
Även Ag2S är olösligt i alla lösningsmedel. Ingen molekyl kan effektivt skilja sina kristallina skikt i Agjoner+ och S.2- solvatiserad.
struktur
Fyra lager S-Ag-S-bindningar kan också ses i strukturen, som rör sig över varandra när det fasta ämnet utsätts för förståelse. Detta beteende betyder att det trots att det är en halvledare är rörligt som många metaller vid rumstemperatur.
S-Ag-S-skikten passar ordentligt på grund av deras vinkelgeometrier som observeras som en zigzag. Med en styrka av förståelse, de rör sig på en axel förskjuten vilket orsakar nya icke-kovalenta interaktioner mellan silveratomer och svavel.
Brytningsindex
2,2
Dielektrisk konstant
6
elektronisk
Ag2S är en amfotär halvledare, det bete sig som om den var av typen n och av typen p. Det är inte heller skört, så det har studerats för dess användning i elektroniska apparater.
Reduktionsreaktion
Ag2S kan reduceras till metalliskt silver genom att bada de svarta bitarna med varmt vatten, NaOH, aluminium och salt. Följande reaktion sker:
3AG2S (s) + 2Al (s) + 3H2O (1) => 6Ag (s) + 3H2S (ac) + Al2O3(S)
nomenklatur
Silver, vars elektroniska konfiguration är [Kr] 4d105S1, det kan bara förlora en elektron: den yttersta orbitalen 5s. Sålunda är Ag kationen+ förblir med en elektronisk konfiguration [Kr] 4d10. Därför har den en unik valens på +1, som bestämmer hur dess föreningar ska kallas.
Svavel har å andra sidan elektronisk konfiguration [Ne] 3s23p4, och det behöver två elektroner för att slutföra sin valensoket. När den erhåller dessa två elektroner (från silver) omvandlas den till svavelanjonen, S2-, med konfiguration [Ar]. Det vill säga, det är isoelektroniskt för argon ädelgas.
Så att Ag2S måste kallas enligt följande nomenklaturer:
systematik
apasulfid disilver. Här betraktar vi antalet atomer av varje element och indikeras av prefix av grekiska täljare.
lager
Silver sulfid. När den har en unik valens av +1, anges den inte med romerska siffror inom parentes: silversulfid (I); vilket är felaktigt.
traditionell
Sulfuro argéntico. Eftersom silver "fungerar" med en valens av +1, läggs suffixet -ico till sitt namn Argentum på latin.
tillämpningar
Några av de nya användningarna för Ag2S är följande:
-Den kolloidala nanopartikeln (med olika storlekar), lösningar har antibakteriell aktivitet, är inte giftiga, och kan därför användas inom områdena medicin och biologi.
-Deras nanopartiklar kan bilda så kallade kvanta punkter. Dessa absorberar och avger strålning med större intensitet än många organiska fluorescerande molekyler, så att de kan ersätta den senare som biologiska markörer.
-Strukturerna av a-Ag2S gör att den uppvisar slående elektroniska egenskaper som används som solceller. Det representerar också en utgångspunkt för syntesen av nya termoelektriska material och sensorer.
referenser
- Mark Peplow. (17 april 2018). Halvledare silver sulfid sträcker sig som metall. Hämtad från: cen.acs.org
- Collaboration: Authors och redaktörer av volymerna III / 17E-17F-41C () Silver sulfiden (Ag 2 S) kristallstruktur. I: O. Madelung, U. Rössler, Schulz M. (eds) Icke-tetraedriskt Bonded Element och Binary Föreningar I. Landolt-Bornstein - Condensed Matter Grupp III (numeriska data och funktionella förhållandena i Science and Technology), vol 41C. Springer, Berlin, Heidelberg.
- Wikipedia. (2018). Silver sulfid. Hämtad från: en.wikipedia.org
- Stanislav I. Sadovnikov & col. (Juli 2016). Ag2S silver sulfid nanopartiklar och kolloidala lösningar: Syntes och egenskaper. Hämtad från: sciencedirect.com
- Azo Materials. (2018). Silver-sulfid (Ag2S) Halvledare. Hämtad från: azom.com
- A. Nwofe. (2015). Utsikter och utmaningar av silversulfidfilmer: En granskning. Avdelningen för materialvetenskap och förnybar energi, Institutionen för industriell fysik, Ebonyi State University, Abakaliki, Nigeria.
- UMassAmherst. (2011). Föreläsningsdemonstrationer: Rengöring av tarnished silver. Hämtad från lecturedemos.chem.umass.edu
- Study. (2018). Vad är Silver Sulfide? - Kemisk formel och användningsområden. Hämtad från: study.com


