Tennklorid (SnCl2) Egenskaper, struktur, användningsområden och risker
den tennklorid (II) eller tennklorid, med kemisk formel SnCl2, är en vit kristallin fast substans, produkt av reaktionen av tenn och en koncentrerad lösning av saltsyra: Sn (s) + 2HCl (conc) => SnCl2(aq) + H2(G). Processen för syntesen (preparatet) består i att tillsätta bitar av tennsorteringar för att reagera med syran.
Efter tillsats av tennstyckena fortsätter den att genomföra en dehydratisering och kristallisation tills det oorganiska saltet erhålles. I denna förening har tenn förlorat två elektroner från sitt valensskal för att bilda bindningar med kloratomer.
Detta kan förstås bättre om man beaktar valens konfiguration av tenn (5s25px2poch0pz0), varav paret av elektroner upptar orbitalen px ges till protoner H+, för att bilda en diatomisk molekyl av väte. Det vill säga detta är en reaktion av redox-typ.
index
- 1 Fysikaliska och kemiska egenskaper
- 1.1 Valencia konfiguration
- 1,2 Reaktivitet
- 1.3 Reducerande aktivitet
- 2 Kemisk struktur
- 3 användningsområden
- 4 risker
- 5 referenser
Fysikaliska och kemiska egenskaper
SnCl länkarna2 Är de joniska eller kovalenta? De fysiska egenskaperna hos tenn (II) klorid utesluter det första alternativet. Smältnings- och kokpunkten för denna förening är 247 ° C och 623 ° C, vilket indikerar svaga intermolekylära interaktioner, vanligt faktum för kovalenta föreningar.
Dess kristaller är vita, vilket översätter till nollabsorption i det synliga spektret.
Valencia konfiguration
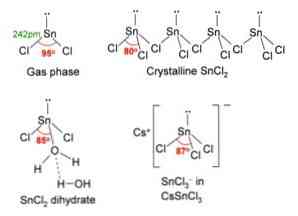
I bilden ovan visas i övre vänstra hörnet en isolerad SnCl-molekyl2.
Den molekylära geometrin bör vara platt eftersom hybridiseringen av den centrala atomen är sp2 (3 orbital sp2 och ren p orbital att bilda kovalenta bindningar), men fritt elektronpar upptar volym och skjuter kloratomerna ner, som ger molekylen en vinkelgeometri.
I gasfas isoleras denna förening, så den interagerar inte med de andra molekylerna.
Som en förlust av paret elektroner i orbitalen px, tennet omvandlas till jon Sn2+ och dess resulterande elektroniska konfiguration är 5s25px0poch0pz0, med alla sina p orbitaler tillgängliga för att acceptera länkar från andra arter.
Cl ioner- koordinera med Sn ion2+ för att ge upphov till tennklorid. Den elektroniska konfigurationen av tenn i detta salt är 5s25px2poch2pz0, kunna acceptera ett annat par elektroner i sin fria orbital pz.
Till exempel kan du acceptera en annan Cl-ion-, bildar komplexet av trigonalplan geometri (en pyramid med triangulär bas) och negativt laddad [SnCl3]-.
reaktivitet
SnCl2 har hög reaktivitet och tendens att uppträda som Lewis-syra (elektronreceptor) för att slutföra sin valensoketett.
Precis som det accepterar en Cl ion-, detsamma händer med vatten som "hydrerar" tennatomen genom att koppla en vattenmolekyl direkt till tenn och en andra vattenmolekyl bildar vätebindningsinteraktioner med den första.
Resultatet av detta är att SnCl2 Det är inte rent, men samordnat med vattnet i dess dihydratiserade salt: SnCl22H2O.
SnCl2 Det är mycket lösligt i vatten och i polära lösningsmedel, eftersom det är en polär förening. Emellertid aktiverar dess löslighet i vatten, mindre än dess massvikt, en hydrolysreaktion (bristning av en vattenmolekyl) för att alstra ett basis och olösligt salt:
SnCl2(aq) + H2O (l) <=> Sn (OH) Cl (s) + HCl (aq)
Dubbelpilen indikerar att en jämvikt upprättas, favoriserad till vänster (mot reaktanterna) om HCl-koncentrationerna ökar. För detta är SnCl-lösningarna2 som används har ett surt pH, för att undvika utfällning av oönskade saltprodukter av hydrolys.
Reduktiv aktivitet
Reagerar med syre i luften för att bilda tenn (IV) klorid eller stanniklorid:
6 SnCl2(aq) + O2(g) + 2H2O (1) => 2SnCl4(aq) + 4Sn (OH) Cl (s)
I denna reaktion oxiderar tenn att bilda en bindning med den elektronegativa syreatomen och ökar sitt antal bindningar med kloratomerna.
I allmänhet stabiliserar de elektronegativa atomer av halogenerna (F, Cl, Br och I) bindningarna i Sn (IV) -föreningarna och detta faktum förklarar varför SnCl2 det är ett reduktionsmedel.
När det oxiderar och förlorar alla sina valenselektroner, Snion4+ det förblir med en 5s konfiguration05px0poch0pz0, att vara paret av elektroner i orbitalet 5s det svåraste att vara "snatched".
Kemisk struktur
SnCl2 presenterar en kristallstruktur av ortorombisk typ, liknande sågrader, där tänderna är täta klorider.
Varje rad är en SnCl-kedja3 bildande en Cl-bro med en annan Sn-atom (Cl-Sn (Cl)2-Cl- ···), vilket kan ses i bilden ovan. Två kedjor, som är kopplade till svaga interaktioner av Sn-Cl-typen, utgör ett lager av arrangemanget, vilket är överlagrat på ett annat skikt, och så vidare tills det kristallina fasta ämnet definieras.
Det fria elektronparet 5s2 orsakar förvrängning i strukturen eftersom den upptar volymen (volymen av det elektroniska molnet).
Sn kan ha ett koordinationstal som är lika med nio, som är lika har nio grannar, dra ett trekantigt prisma med detta ligger i centrum av den geometriska figuren och Cl vid toppunkterna, tillsammans med annan Cl belägen i varje av prismans fyrkantiga ytor.
Detta är lättast observeras när man överväger en kedja där Sn (mörkgrå områden) pekar uppåt, och de tre Cl kopplad till denna triangelform golvet, medan de tre övre Cl bilda den triangulära tak.
tillämpningar
I organisk syntes används den som ett reduktionsmedel för aromatiska nitroföreningar (Ar-NO2 à Ar-NH2). Eftersom dess kemiska struktur är laminär, finner den användning i katalysens värld av organiska reaktioner, förutom att den är en potentiell kandidat för katalytiskt stöd.
Dess reducerande egendom används för att bestämma närvaron av guldföreningar, att belägga glasögon med silverspeglar och att fungera som en antioxidant.
Även i sin molekylär geometri trigonalpyramid (: SnX3- M+) används som en Lewis-bas för syntes av ett stort antal föreningar (såsom Pt-klusterkomplexet)3Sn8cl20, där det elektronfria paret är samordnat med en Lewis-syra).
risker
SnCl2 Det kan skada vita blodkroppar. Det är frätande, irriterande, cancerframkallande och har höga negativa effekter på de arter som bevarar marina ekosystem.
Det kan sönderfalla vid höga temperaturer och frigöra den skadliga klorgasen. I kontakt med starkt oxiderande ämnen utlöser det explosiva reaktioner.
referenser
- Shiver & Atkins. (2008). Oorganisk kemi i Elementen i grupp 14 (fjärde upplagan, s. 329). Mc Graw Hill.
- ChemicalBook. (2017). Hämtat den 21 mars 2018 från ChemicalBook: chemicalbook.com
- PubChem. (2018). Tennklorid. Hämtad 21 mars 2018, från PubChem: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2017). Tenn (II) klorid. Hämtad 21 mars 2018, från Wikipedia: en.wikipedia.org
- E. G. Rochow, E. W. (1975). Tysklands kemi: tenn och bly (första red.). p-82,83. Pergamom Press.
- F. Hulliger. (1976). Strukturell kemi av lager-typfaser. P-120.121. D. Reidel Publishing Company.



