Kinyoun färgning grund och tekniker
den Kinyoun färgning Det är en färgteknik som används för att fånga syrafasta bakterier och sura parasiter. Det föddes från modifieringen av färgningen av Ziehl-Neelsen; Båda teknikerna tolkas på samma sätt men de skiljer sig åt i två delar: vid framställning av huvudreagenset och därigenom använder Kinyoun-tekniken inte värme.
Av denna anledning är det också känt som kallmodifierad Ziehl-Neelsen eller Kinyoun kallfärgning. Det anges för färgning av Mycobacterium tuberculosis, Mycobacterium leprae, atypiska mykobakterier, Nocardias sp, Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris och Cyclosporas cayetanensis.
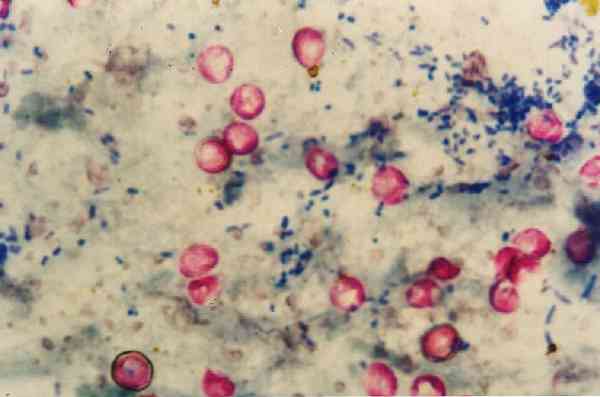
Det är värt att nämna att Nocardias fläckar svagt med denna teknik eftersom de är delvis syrafast alkohol, så för denna genre finns det en modifiering av metodiken.
I sin tur kombinerades Kinyoun-kalltekniken med trichromtekniken modifierad av Didier för detektering av coccidia (Cryptosporidium parvum och Isospora belli) och sporer av mikrosporidier (Enterocytozoon bieneusi och Encephalitozoon intestinalis).
index
- 1 Stiftelsen
- 2 Teknik
- 2.1 Material
- 2.2 Framställning av Kinyoun-fenikerad fuchsin
- 2.3 Framställning av alkohol-syra
- 2.4 Framställning av metylenblått kontrastfärg
- 2,5 Kinyoun fläckteknik
- 2.6 Speciell Kinyoun-teknik för nocardier
- 2.7 Kombinerad teknik av fenol och trichromic fuchsin modifierad av Didier
- 2.8 Kvalitetskontroll
- 3 Kinyoun-teknik jämfört med Ziehl-tekniken -Neelsen
- 4 Referens
foundation
Det primära reagenset är den carbolfuchsin färgning eller fuksin, som har egenskapen att binda till befintliga karbololja syror inuti cellväggen vaxartad lipid rika (mykoliska syror) av mykobakterier och vissa parasiter.
Den fackföreningen motverkas inte av syraavfärgning; Därför definieras mikroorganismer som syrabeständig alkohol.
Till skillnad från Ziehl-Neelsen teknik som fixerar färgämnet genom värme-, i tekniken Kinyoun detta steg är inte nödvändigt, eftersom lösningen fuksin förbereda för denna teknik innehåller hög koncentration av fenol.
Fenol löser lipidmaterialet i cellväggen, vilket möjliggör införandet av Carbol Fuchsin-färgämnet. Efter det att färgämnet tränger in, förblir det fixerat trots tvätt med alkohol-syra.
På detta sätt tar de sura resistenta mikroorganismerna den karakteristiska röda färgen, medan allt som inte är syrafast alkohol blir missfärgad och färgad blå..
teknik
material
- Modifierat fenoliskt fuchsin.
- alkohol ättiksyra.
- Methylenblå.
Framställning av Kinyoun-fenikerad fuchsin
- Grundläggande fuchsin: 4 gr.
- Fenol: 8 ml.
- Alkohol (95%): 20 ml.
- Destillerat vatten: 100 ml.
Den grundläggande fuchsinen i alkohol måste lösas långsamt, blandas ständigt. Därefter smältes den kristalliserade fenolen i ett vattenbad vid 56 ° C. När det är löst, tillsätt 8 ml till fuchsinlösningen som framställts ovan.
Framställning av alkohol-syra
- Koncentrerad saltsyra: 3 ml.
- Etanol (95%): 97 ml.
Det måste mätas, sammanfogas och blandas.
Framställning av metylenblått kontrastfärg
- Metylenblå: 0,3 g.
- Destillerat vatten: 100 ml.
Den vägs och upplöses.
Kinyoun fläckteknik
1- förbereda ett utstryk prov direkt, som kan vara sputum, lungvätska, urinsediment, cerebrospinalvätska eller avföring, bland andra; eller från en suspension av mikroorganismer erhållna från rena kolonier utvecklade i primära odlingsmedier.
2- Fixa smeten med värme.
3- Placera smeten på färgbroen och täck med Kinyouns fenoliska fuchsinreagens beredda. Låt det sitta i 3 eller 5 minuter.
4- Tvätta med destillerat vatten.
5- Bleach med syraalkohol i 3 minuter och tvätta igen med destillerat vatten.
6- Blek igen med sur alkohol i 1 eller 2 minuter tills inget mer färgämne släpas.
7- Tvätta med destillerat vatten och låt avta, placera gliden i upprätt läge.
8- Täck förberedelsen med metylenblå och låt den stå i 4 minuter.
9- Tvätta med destillerat vatten och låt lufttorka.
10 - Undersök vid 40X och sedan vid 100X.
Om du vill ha förbättrade och påskyndas färgning syraalkohol resistenta mikroorganismer, är en droppe av ett vätmedel tillsättes (såsom Tergitol nr 7) en 30 eller 40 ml fuksin Kinyoun.
Vissa laboratorier ändrar metylenblått kontrastfärg för ljusgrön eller pikrinsyra; den första ger en grön färg till bakgrunden och den andra genererar en gul färg.
Kinyoun teknik speciell för Nocardias
För att förbättra färgningen av Nocardia-bakterier används en modifiering av Kinyoun-färgning. Tekniken är som följer:
1- Täck smeten med Kinyoun-fenikat fuchsin i 3 minuter.
2- Tvätta med destillerat vatten.
3- Blekat kort med 3% beredd syraalkohol tills inget mer färgämne medföres.
4- Tvätta igen med destillerat vatten.
5- Täck förberedelsen med metylenblå och låt den stå i 30 sekunder.
6- Tvätta med destillerat vatten och låt lufttorka.
Kombinerad teknik för fenol och trichromic fuchsin modifierad av Didier
Denna teknik rekommenderas för analys av pallprover på jakt efter coccidia och sporer av Microsporidium sp på samma gång Förfarandet som skall följas är följande:
1- Täck smeten med Kinyoun fenol fuchsin i 10 minuter.
2- Ta bort färgämnet och tvätta med destillerat vatten.
3- blekmedel i 30 sekunder med alkoholklorvätesyra.
4- Tvätta igen med destillerat vatten.
5- Täck smet med trikromösning i 30 minuter vid 37 ° C.
6- Tvätta med destillerat vatten.
7- Avfärgad i 10 sekunder med alkoholättiksyra.
8- Tvätta smeten i 30 sekunder med 95% etanol.
Kvalitetskontroll
Som en positiv kontroll framställs smuts med stammar av Mycobacterium tuberculosis och färgas med de beredda reagenserna för att verifiera att bakterierna tar rätt färg (rödfuksi).
Negativa kontroller kan också användas genom att förbereda utstrykningar med någon stam som inte är syrafast alkohol, vilket verifierar att hela provet tar kontrastens färg.
Kinyoun-teknik jämfört med Ziehl-tekniken -Neelsen
Kinyoun teknik är enklare eftersom den eliminerar steget med uppvärmning, men dess främsta fördel är att den undviker utsläpp av ångor, mycket giftiga och orsaka långsiktig cancer. Därför är Kinyoun-färgning säkrare för färgningspersonal.
Det är viktigt att ta hänsyn till att det är nödvändigt att se till att reagensen inte kommer i direkt kontakt med huden, eftersom de är frätande och blekmedlet är brandfarligt.
När det gäller nackdelarna indikerar ett negativt smet inte nödvändigtvis att mikroorganismen inte är närvarande. Dessutom kan förekomst av celldetritus orsaka falska positiva effekter, vilket genererar förvirring i diagnosen.
referens
- Tillämpad klinisk kemi (2016). BK Kinyoun Kit. Finns på: cromakit.es
- Orozco-Rico Miguel. Kinyoun fläck och två Coccidia i HIV. Medical Journal MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Mikrobiologisk diagnos av Bailey & Scott. 12 ed. Argentina. Panamericana S.A Redaktionell.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnos. (5: e upplagan). Argentina, Editorial Panamericana S.A..
- Wikipedia bidragsgivare. "Kinyoun fläck." Wikipedia, den fria encyklopedin. Wikipedia, den fria encyklopedin, 8 februari 2018. Web. 5 jan 2019.
- Combol A, Fernandez N, Figueredo E, cradling Zanetta E. Genomförande av ett färgningstekniken för samtidig diagnos av koccidier och microsporidia. Hygieninstitutet för Republiken Universitetet. Montevideo. Uruguay. Finns på: higiene.edu.uy


