Giemsa färgningsgrund, material, teknik och användningsområden
den Giemsa fläck är en typ av färgning av kliniska prover, baserat på blandningen av syra och basiska färgämnen. Dess tillkomst inspirerades av det arbete som Romanowsky, där Gustav Giemsa, kemist och bakteriolog från Tyskland, han fulländade lägga glycerol för att stabilisera föreningar.
Förändringarna som genererades till Romanowskys ursprungliga teknik gjorde det möjligt att förbättra de mikroskopiska observationerna avsevärt och tekniken döptes därför med namnet Giemsa stain.
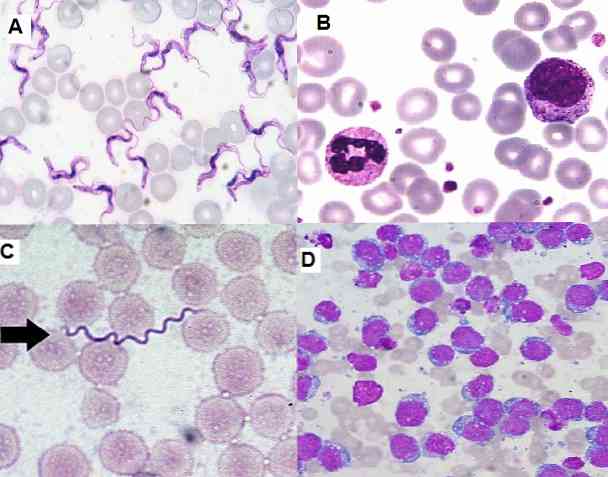
Eftersom det är en enkel teknik att utföra, mycket funktionell och ekonomisk, används den för närvarande i det kliniska laboratoriet för hematologiska utpressningar, benmärgsprover och vävnadssektioner..
Giemsa-färgningstekniken är mycket användbar för cytologiska studier, eftersom det medger observation av specifika strukturer av celler. Denna teknik fläckar cytoplasma, kärnor, nukleol, vakuoler och granuler av cellerna, att kunna skilja även fina spår av kromatin.
Dessutom kan signifikanta förändringar i kärnans storlek, form eller färg detekteras, där det är möjligt att visualisera förlusten av kärn-cytoplasmförhållandet.
Å andra sidan tillåter det att identifiera omogna celler i benmärg och perifert blod, vilket är viktigt för diagnos av allvarliga sjukdomar som leukemi. Det är också möjligt att upptäcka hemoparasiter, extra och intracellulära bakterier, svampar, bland andra.
I cytogenetik används det ganska, eftersom det är möjligt att studera mitos av celler.
index
- 1 Stiftelsen av Giemsa-färgningen
- 2 material
- 2.1 Material för beredning av moderlösningen
- 2.2 Preparatläge för moderlösningen
- 2.3 Material för att förbereda buffertlösningen
- 2.4 Slutlig beredning av färgämnet
- 2.5 Ytterligare material som behövs för att utföra färgningen
- 3 Teknik
- 3.1 färgprocess
- 4 verktyg
- 4,1 hematologi
- 4.2 Mykologi
- 4.3 Bakteriologi
- 4.4 Parasitologi
- 4,5 cytologi
- 4,6 cytogenetika
- 5 Forskning som visar effektiviteten hos Giemsa-färgning
- 6 rekommendationer för bra färgning
- 7 Vanliga misstag i färgningen av Giemsa
- 7.1 Extremt blå färgning
- 7.2 För mycket rosa färg
- 7.3 Förekomst av utfällningar i smeten
- 7.4 Närvaro av morfologiska artefakter
- 8 Lagringsläge
- 9 referenser
Stiftelsen av Giemsa-färgningen
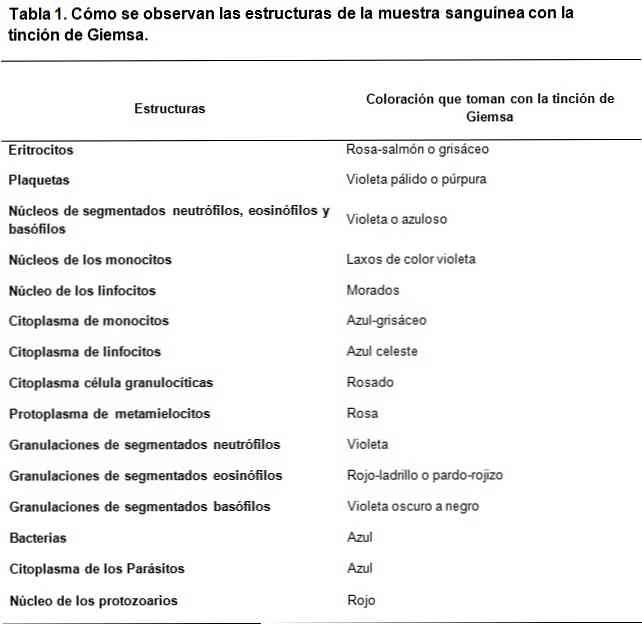
Romanowsky-typfärgerna är baserade på användningen av en kontrast mellan sura och basiska färgämnen, för att uppnå färgning av respektive bas- och syrastrukturer. Såsom kan ses är det en affinitet av syrafärgämnena för att färga de grundläggande strukturerna och vice versa.
Det använda basfärgämnet är metylenblått och dess oxiderade derivat (Azure A och Azure B), medan syrafärgen är eosin.
Syrastrukturerna hos cellerna är nukleinsyrorna, granulerna av de segmenterade basofilerna bland annat, därför kommer de att färgas med metylenblå.
På samma sätt är de grundläggande strukturerna hos cellerna hemoglobin och några granuler, såsom de som ingår i segmenterade eosinofiler, bland andra; Dessa kommer att färgas med eosin.
Å andra sidan, på grund av det faktum att metylenblått och azurblåkar karakteriseras av metakromatiska färgämnen, kan de åstadkomma en varierande ton till de olika strukturerna i enlighet med belastningen av polyanjoner de äger..
Sålunda den strategiska kombination av sura och basiska färgämnen kan utveckla ett brett spektrum av färger, i enlighet med de biokemiska egenskaperna hos varje struktur, pacing ljusblå mörkblå nyanser, lila och lila i fallet med de sura strukturer.
Medan färgningen från eosin är stabilare, genererar färger mellan röd-orange och lax.
material
Material för beredning av moderlösningen
Beredningen av stamlösningen kräver att man väger 600 mg pulveriserat Giemsa-färgämne, som mäter 500 cc acetonfri metylalkohol och 50 cc neutral glycerin.
Preparatsläge för moderlösningen
Placera det tunga Giemsa-pulvret i en murbruk. Om det finns klumpar ska de sprutas. Lägg sedan till en märkbar mängd av det uppmätta glycerinet och blanda mycket bra. Den erhållna blandningen hälles i en mycket ren gult flaska.
Resten av glycerinet placeras i morteln. Blanda igen för att rengöra resterande färgämne som har fastnat på murbrukets väggar och häll i samma flaska.
Flaskan täcks och transporteras i 2 timmar i ett vattenbad vid 55ºC. Under en bain-marie-bad, rör lätt blandningen varje halvtimme eller så.
Därefter får blandningen svalna för att placera alkoholen. Tidigare placerades en del av den uppmätta alkoholen i morteln för att sluta tvätta vad som finns kvar av färgämnet och sedan tillsättes blandningen tillsammans med resten av alkoholen.
Denna beredning bör tillåtas mogna i minst 2 veckor. Den del som används av moderlösningen måste filtreras.
För att undvika förorening av preparatet rekommenderas att passera den del som kommer att användas i ständig användning till en liten bärnstenflaska med droppare. Ladda varje gång reagenset löper ut.
Material för att förbereda buffertlösningen
Å andra sidan framställs en buffertlösning vid pH 7,2 enligt följande:
6,77 gram natriumfosfat (vattenfritt) vägs (NaHPO4), 2,59 g kaliumdihydrogenfosfat (KH)2PO4) och destillerat vatten upp till 1000 cc.
Slutlig beredning av färgämnet
För framställning av den slutliga färgningslösningen mäts 2 cc av den filtrerade stamlösningen och blandas med 6 cc av buffertlösningen. Blandningen omröres.
Ett relevant faktum som måste beaktas är att teknikerna för beredning av färgämnet kan förändras enligt det kommersiella huset.
Ytterligare material som behövs för att utföra färgningen
Bortsett från de beskrivna materialen, bör den vara försedd med färgbroar, vattenskärmar eller buffert för tvättning, ark för föremål eller lock, en stoppur för att kontrollera färgtider och blottpapper eller något material som kan användas för att torka ( gasbind eller bomull).
teknik
Färgprocess
1) Före färgning måste du sprida provet på en ren glida..
Proverna kan vara blod, benmärg, skär av histologiska vävnader eller cervico-vaginala prover. Det rekommenderas att ytorna är tunna och har 1 eller 2 timmars torkning innan de färgas.
2) Alla ark som du måste färgläggs placeras på en färgad bro. Arbeta alltid i samma ordning och identifiera varje ark väl.
3) Placera några droppar 100% metylalkohol (metanol) på smeten och låt i 3 till 5 minuter för att fixera och dehydrera provet.
4) Kassera metanolen i arket och låt lufttorka.
5) När du är torr, placera den slutliga färglösningen med en droppare tills hela arket är täckt. Lämna på i 15 minuter. Vissa författare rekommenderar upp till 25 min. Beror på det kommersiella huset.
6) Töm färgen och tvätta smeten med destillerat vatten eller med 7,2 buffertlösning.
7) Låt arken torka utomhus på ett blottpapper, placerat vertikalt med hjälp av ett stöd.
8) Torka baksidan av objektglaset med en gasväv eller bomullspinne fuktad med alkohol för att ta bort eventuellt kvarvarande färgämne.
verktyg
Giemsa-färgningstekniken används på flera områden, bland annat: hematologi, mykologi, bakteriologi, parasitologi, cytologi och cytogenetik.
hematologi
Det är det vanligaste verktyget som ges till denna färgning. Med det kan vi identifiera var och en av de celler som finns i prov av benmärg eller perifert blod. Förutom att uppskatta antalet av varje serie, kunna detektera leukocytos eller leukopeni, trombocytopeni etc..
Eftersom det är känsligt för att identifiera omogna celler är det relevant vid diagnos av akuta eller kroniska leukemier. Det är också möjligt att bland annat diagnostisera anemi, såsom sicklecellsjukdom, sicklecellsjukdom..
mykologi
I det här området är det vanligt att använda det för att söka efter Histoplasmakapselatum (intracellulär dimorfisk svamp) i vävnadsprover.
bakteriologi
I hematologiska smuts färgade med Giemsa är det möjligt att detektera Borrelias sp hos patienter som har sjukdomen kallad feber recurrentis. Spirocheter är rikliga bland erytrocyter, i prover som tas vid febriltoppen.
Det är också möjligt att visualisera intracellulära bakterier som Rickettsias sp och Chlamydia trachomatis i infekterade celler.
parasitologi
På området parasitologi har Giemsa-färgning möjliggjort diagnos av parasitiska sjukdomar som malaria, Chagas sjukdom och leishmaniasis..
I de två första parasiterna Plasmodium sp och Trypanosoma cruzi respektive de kan visualiseras i de infekterade patienternas perifera blod, de kan hittas i olika steg i enlighet med den fas i vilken sjukdomen är.
För att förbättra sökningen efter blodsparasiter rekommenderas att använda Giemsa fläck blandad med May-Grünwald färgämne.
På samma sätt kan kutan leishmaniasis diagnostiseras vid utvärdering av prover av hudbiopsier färgade med Giemsa, där parasiten finns.
cytologi
Giemsa-färgning används också för den cytologiska studien av endokerviska prover, även om det inte är den mest använda tekniken för detta ändamål.
Men i fall av brist på resurser kan användas, med en funktionalitet som liknar den som erbjuds av Papanicolaou-tekniken och till en lägre kostnad. Det kräver emellertid expertis från examinatorens sida.
cytogenetik
En relevant egenskap hos Giemsa-färgning är dess förmåga att binda starkt till regioner rik på DNA-adeniner och tyminer. Detta gör det möjligt för DNA att visualiseras under mitos av cellerna, i olika tillstånd av kondensation.
Dessa studier är nödvändiga för att detektera kromatiska aberrationer, såsom duplikeringar, deletioner eller translokationer av de olika regionerna av kromosomerna..
Forskning som visar effekten av Giemsa-färgning
Cannova et al (2016), jämförde 3 färgtekniker för diagnos av kutan leishmaniasis.
För detta använde de prover erhållna från ett försöksdjur (Mesocrisetus auratus) experimentellt inokulerades med Leishmanias.
Författarna visade att Giemsa-färgning var bättre än Pap-mart® och Gaffney-färgning. Därför ansåg de att Giemsa fläcken är idealisk för att diagnostisera kutan leishmaniasis.
De utmärkta resultat som erhållits av författarna är på grund av kombinationen av färgämnen som utgör blandningen av Giemsa presenteras de villkor som är nödvändiga för att skapa en gynnsam kontrast, vilket gör klar åtskillnad strukturer amastigoter både inträ- och extracellulärt.
De andra teknikerna (Pap-mart® och Gaffney) gjorde det också, men på ett svagare sätt och därför svårare att visualisera. Därför rekommenderas Giemsa-fläcken för den parasitologiska diagnosen av leishmaniasis.
På samma sätt utvärderades en studie av Ramírez et al (1994) validiteten av Giemsa och Lendrum-fläckar i konjunktivsmärtor för identifiering av Chlamydia trachomatis.
Författarna bestämde att Giemsa och Ledrum-färgning har samma specificitet, men Giemsa var känsligare.
Detta förklarar varför Giemsa-färgning för närvarande används mest för diagnos av chlamydialinfektioner, speciellt om det finns få resurser.
Rekommendationer för bra färgning
Torkningen av arken bör inte accelereras. Försiktighetstiden måste vänta på att torka den i friluft. Cirka 2 timmar.
Färg omedelbart efter 2 timmar för bästa resultat.
För att smutsarna ska fixeras och färgas bättre måste provet fördelas på arket på ett sådant sätt att ett tunt och enhetligt skikt kvarstår.
Det föredragna blodprovet är kapillären, eftersom smeten göres direkt från bloddroppen och därför har provet ingen tillsats, vilket gynnar upprätthållandet av cellstrukturer.
Om venös blod används, ska emellertid EDTA användas som ett antikoagulant och inte heparin, eftersom de senare vanligtvis deformerar cellerna.
Vanliga misstag i färgningen av Giemsa
Vid utövandet av denna färgning kan misstag göras. De framgår av plötsliga förändringar i strukturernas nyanser.
Extremt blå färgning
Det kan bero på:
- Mycket tjocka utstrykningar
- Överstiger färgningstiden
- För lite tvätt.
- Användning av reagens långt över neutral pH (alkalisk).
Under dessa förhållanden färgerna på följande strukturer är förvrängda, så att erytrocyter snarare än färgat rosa lax blir grön, kommer granulat av eosinofiler som ska färgas rött tegel blåaktig eller grå vända och så vidare kommer avvikelse i de vanliga tonaliteterna.
För mycket rosa färg
Det kan bero på:
- Otillräcklig färgningstid.
- Förlängd eller överdriven tvätt.
- Dålig torkning.
- Användning av mycket sura reagens.
I det här fallet kommer de strukturer som normalt färgas blå inte vara nästan synlig, medan strukturerna är färgade rosa nyanser kommer att kraftigt överdrivna.
Exempel: erytrocyter ta en stark klarröd eller orange färg, kommer kärn kromatin ljusrosa och granulat av eosinofiler färgas röda intensiv.
Förekomst av utfällningar i smeten
Orsakerna kan vara:
- Använd smutsiga eller dåligt tvättade ark.
- Låt inte smetret torka väl.
- Lossa fixeringslösningen för länge.
- Otillräcklig tvättning vid slutet av färgning.
- Otillräcklig filtrering eller icke-filtrering av färgämnet som används.
Förekomst av morfologiska artefakter
Morfologiska artefakter kan förekomma i smutsarna, vilket gör det svårt att visualisera och tolka de närvarande strukturerna. Detta beror på:
- Typ av antikoagulant som används, såsom heparin.
- Användning av smutsiga, skadade eller feta ark.
Lagringsläge
Efter förberedelse bör färgen hållas vid rumstemperatur (15-25 ° C) för att förhindra att färgen faller ut. Det måste förvaras i en sluten gultbehållare.
referenser
- Cannova D, Brito E och Simons M. Utvärdering av färgtekniker för diagnos av kutan Leishmaniasis. Salus. 2016; 20 (2): 24-29.
- PanReac Applichem ITW Reagents. Giemsa fläck. Version 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Spanien.
- Clark G.-färgprocedurer (1981), 4: e. Williams & Willkins.
- Tillämpad klinisk kemi Giemsa färgämne för diagnos in vitro. Distributör: cromakit.es
- Ramírez I, Mejía M, García de la Riva J, Hermes F och Grazioso C. Giemsas och Lendrum-fläckarnas giltighet i samband med konjunktivutsprutning för identifiering av Chlamydia trachomatis. Bol av Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. Allmän Mykologi. 1994. 2: e utgåvan Universidad Central de Venezuela, Bibliotek utgåvor. Venezuela, Caracas.
- "Giemsa fläck." Wikipedia, den fria encyklopedin. 1 sep 2017, 01:02 UTC. 6 dec 2018, en.wikipedia.org.


