Theory of the Sea of Electron Fundamentals, Egenskaper och Nackdelar
den elektronteori om elektroner Det är en hypotes som förklarar ett exceptionellt kemiskt fenomen som uppstår i metallbindningar mellan element med låga elektronegativiteter. Det handlar om delningen av elektroner mellan olika atomer kopplade av metallbindningar.
Den elektroniska densiteten mellan dessa länkar är sådan att elektronerna delocaliseras och bildar ett "hav" där de rör sig fritt. Det kan också uttryckas med kvantmekanik: vissa elektroner (vanligen en till sju per atom) är anordnade i orbital med flera centra som sträcker sig över metallytan.
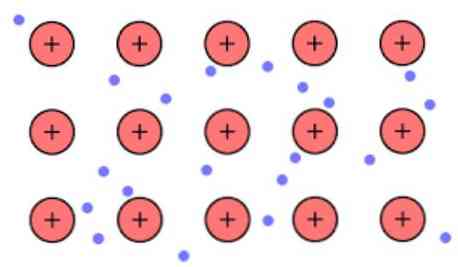
Även elektroner behåller viss plats i metallen, även om sannolikhetsfördelningen av det elektroniska molnet har högre densitet runt vissa specifika atomer. Detta beror på det faktum att när man applicerar en viss ström visar de sin konduktivitet i en specifik riktning.
index
- 1 Grundläggande av teorin om havet av elektroner
- 2 egenskaper
- 2.1 Offset i form av lager
- 2.2 Teorin av havet av elektroner i metallkristaller
- 3 Nackdelar med teorin
- 4 referenser
Grundläggande av teorin om havet av elektroner
Metallelementen har en stor tendens att donera elektroner från sin sista energinivå (valensskikt), på grund av deras joniseringsenergi så låg i förhållande till de andra elementen.
Genom att veta detta kan varje metallelement betraktas som en katjon kopplad till elektronen på sin sista energinivå, vilket skulle vara mer benägen att donera.
Som en metall som har ett stort antal atomer som är sammanlänkade, kan det antas att metallen bildar en grupp av metallkatjoner som är nedsänkta i ett slags hav av valenselektroner, som har en stor delokalise.
Medan de elektrostatiska attraktionskrafterna mellan katjonen (positiv laddning) och elektronmikroskopi (negativ laddning) har metallatomer bundna starkt föreställer sig delokalisering av de valenselektroner uppträder som en elektrostatisk adhesiv behåller länkad till metallkatjonerna.
På detta sätt kan det utläsas att ju större antal elektroner som finns i valensskiktet av en metall, kommer denna typ av elektrostatiskt bindemedel att ha en större styrka.
egenskaper
Teorin för elektron havet erbjuder ett enkelt till egenskaper hos metallspecies som hållfasthet, ledningsförmåga, duktilitet och smidbarhet förklaring, som varierar från metall till metall.
Har det visat sig att den resistens till de stora utlokalisering metaller med elektroner måste, som genererar en hög sammanhållningskraft mellan atomer som bildar.
På detta sätt är duktilitet känt som förmågan hos vissa material att tillåta deformation av deras struktur utan att ge tillräckligt att bryta när de utsätts för vissa krafter.
Offshoring i form av lager
Både duktilitet och formbarhet av metall bestäms av det faktum att valenselektronerna delokaliserad i alla riktningar i skikt, vilket får dem att röra sig över varandra mot verkan av en yttre kraft, undviker brytningen av metallstrukturen men tillåter dess deformation.
På samma sätt tillåter rörelsefriheten hos de delokaliserade elektronerna att det finns ett flöde av elektrisk ström, vilket gör metallerna mycket goda ledningsförmåga hos elektricitet.
Vidare detta fenomen av fri elektronrörelse tillåter momentöverföring mellan regionerna av metallen, som främjar värmeöverföringen och gör metaller manifestera en värmeledningsförmåga.
Teorin om havet av elektroner i metallkristaller
Kristallerna är fasta ämnen som har fysikaliska och kemiska egenskaper såsom densitet, smältpunkt och hårt som fastställs av den typ av krafter som gör de partiklar som fastnat i varandra bildar.
På ett sätt anses det att kristaller av metalltyp har de enklaste strukturerna, eftersom varje "punkt" av kristallnätet har upptas av en atom av metallen själv.
På samma sätt har det fastställts att metallkristallens struktur är kubisk och fokuserar på ansikten eller kroppen.
Dessa arter kan dock också vara hexagonala i form och ha en ganska kompakt packning, vilket ger dem den enorma densitet som är karakteristisk.
På grund av denna strukturella orsak skiljer sig de bindningar som bildas i metallkristallerna från de som förekommer i de andra kristallformerna. De elektroner som kan bilda bindningar delokaliseras genom hela den kristallina strukturen, såsom förklarats ovan.
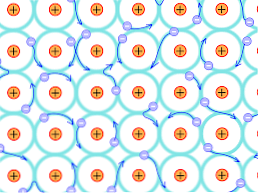
Nackdelar med teorin
I metalliska atomer finns en liten mängd valenselektroner i proportion till deras energiska nivåer; det vill säga det finns en större mängd tillgängliga energistandarder än mängden elektroner som är länkade.
Detta innebär att, eftersom det finns en stark elektron utlokalisering och energiband som har fyllt delvis, kan elektronerna rör sig genom gitterstrukturen när den utsätts för från det elektriska fältet från utsidan, förutom att bilda havet elektron som stöder nätets permeabilitet.
Så föreningen av metaller tolkas som ett konglomerat av positivt laddade joner kopplade med ett hav av elektroner (negativt laddad).
Det finns emellertid egenskaper som inte förklaras av denna modell, såsom bildandet av vissa legeringar mellan metaller med specifika kompositioner eller bland annat stabiliteten hos kollektiva metallkopplingar..
Dessa nackdelar förklaras av kvantmekanik, eftersom både denna teori många andra tillvägagångssätt har fastställts baserat på den enklaste modellen av en enda elektron, samtidigt som man försöker tillämpa i mer komplexa strukturer av multielectron atomer.
referenser
- Wikipedia. (2018). Wikipedia. Hämtad från en.wikipedia.org
- Holman, J. S. och Stone, P. (2001). Kemi. Hämtad från books.google.co.ve
- Parkin, G. (2010). Metall-metallbindning. Hämtad från books.google.co.ve
- Rohrer, G. S. (2001). Struktur och bindning i kristallina material. Hämtad från books.google.co.ve
- Ibach, H. och Lüth, H. (2009). Solid State Physics: En introduktion till materialvetenskapens principer. Hämtad från books.google.co.ve


