Molekylära geometrityper och exempel
den molekylär geometri eller molekylär struktur är den rumsliga fördelningen av atomer runt en central atom. Atomerna representerar regioner där det finns en hög elektronisk densitet, och betraktas därför som elektroniska grupper, oavsett de länkar som bildas (singel, dubbel eller trippel).
Detta koncept kommer från kombinationen och de experimentella data för två teorier: valensbindning (TEV) och repulsion av de elektronparen valensskalet (VSEPR). Medan den första definierar länkarna och deras vinklar fastställer den andra geometrin och därmed molekylstrukturen.

Vilka geometriska former är molekyler som kan anta? De två tidigare teorierna ger svaren. Enligt VSEPR måste atomerna och paren av fria elektroner vara anordnade i rymden på ett sådant sätt att den elektrostatiska repulsionen mellan dem minimeras..
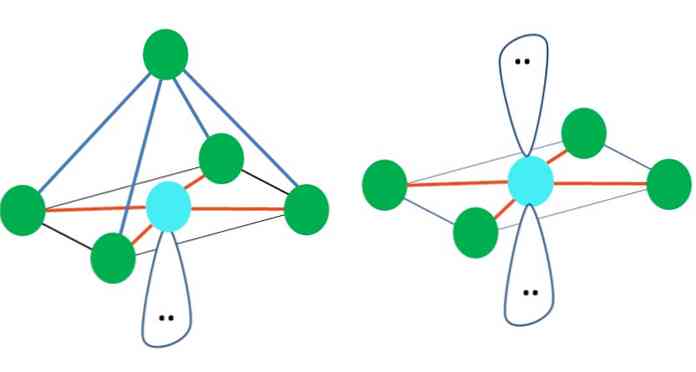
Så, de geometriska formerna är inte godtyckliga, men leta efter den mest stabila designen. Till exempel i den övre bilden kan en triangel ses till vänster och en oktaedron till höger. De gröna prickarna representerar atomerna och apelsinbanden länkarna.
I triangeln är de tre gröna punkterna inriktade på en separering av 120º. Denna vinkel, som är lika med bindningen, tillåter atomerna att avvika varandra så lite som möjligt. Därför antar en molekyl med en central atom kopplad till tre andra en trigonalplan geometri.
VSCR förutsäger emellertid att ett fritt par elektroner i den centrala atomen kommer att snedvrida geometrin. För fallet med trigonalplanet kommer detta par att trycka ner de tre gröna punkterna, vilket resulterar i en trigonal pyramidgeometri.
Detsamma kan också hända med bildens oktaedron. Därmed separeras alla atomer på det mest stabila sättet.
index
- 1 Hur man kan veta i förväg en molekyls geometri av en atom X?
- 2 typer
- 2.1 linjär
- 2.2 Vinkel
- 2.3 Tetrahedral
- 2,4 trigonalbipyramid
- 2,5 oktahedral
- 2.6 Andra molekylära geometrier
- 3 exempel
- 3.1 Linjär geometri
- 3.2 Vinkelgeometri
- 3.3 Trigonal plan
- 3,4 Tetrahedral
- 3,5 trigonal pyramid
- 3,6 trigonal bipyramid
- 3,7 Oscillering
- 3,8 form av T
- 3,9 oktahedralen
- 4 referenser
Hur man kan veta i förväg en molekylär geometri av en atom X?
För detta är det nödvändigt att också överväga paren av fria elektroner som elektroniska grupper. Dessa, tillsammans med atomer, kommer att definiera vad som är känt som elektronisk geometri, vilket är en oskiljaktig kamrat av molekylär geometri.
Från den elektroniska geometrin och genom att det har upptäckts av Lewis-strukturen kan paren av fria elektroner vi fastställa vad molekylgeometrin kommer att vara. Summan av alla molekylära geometrier kommer att ge en översikt över den globala strukturen.
Typ
Såsom ses i huvudbilden beror molekylgeometrin på hur många atomer som omger den centrala atomen. Men om ett par elektroner är närvarande utan delning kommer det att förändra geometrin eftersom det upptar mycket volym. Därför utövar den en sterisk effekt.
Enligt detta kan geometri presentera en rad karakteristiska former för många molekyler. Och detta är där olika typer av molekylär geometri eller molekylär struktur uppstår.
När är geometri lika med strukturen? Båda betecknar detsamma endast i fall där strukturen inte har mer än en typ av geometri; annars måste alla aktuella typer beaktas och strukturen ges ett globalt namn (linjärt, grenat, globalt, platt etc.).
Geometrin är särskilt användbara för att förklara strukturen hos ett fast ämne från dess strukturella enheter.
linjär
Alla kovalenta bindningar är riktningar, så länken A-B är linjär. Men kommer AB-molekylen att vara linjär?2? Om ja, är geometrin helt enkelt representerad som: B-A-B. De två B-atomer separeras med en vinkel av 180 ° och enligt TEV måste A ha sp-hybrid-orbitaler.
vinkel
Det kan i första hand antas en linjär geometri för AB-molekylen2; Det är dock viktigt att rita Lewis struktur innan man når en slutsats. Att rita strukturen hos Lewis kan identifiera antalet par av elektroner utan att dela (:) på A-atomen.
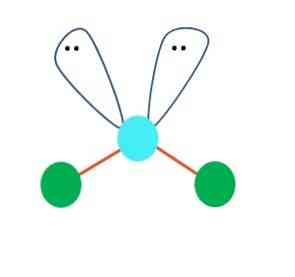
När detta är så trycker de på de två atomerna av B på toppen av elektronparen och ändrar deras vinklar. Som en följd slutar den linjära molekylen B-A-B att bli en V, en boomerang eller en vinkelgeometri (toppbild)
Vattenmolekylen, H-O-H, är det perfekta exemplet för denna typ av geometri. I syreatomen finns två par elektroner utan att dela som är orienterade i en ungefärlig vinkel på 109º.
Varför den här vinkeln? Eftersom elektronisk geometri är tetraedral, som har fyra vertikaler: två för H-atomer och två för elektroner. I bilden ovan noteras att de gröna prickarna och de två "loberna med ögonen" ritar en tetrahedron med den blåaktig punkten i centrum.
Om O inte har fria elektroner paren, vattnet bildar en linjär molekyl, och minska polaritet hav, sjöar, etc., skulle förmodligen inte existera som känt.
tetraedrisk
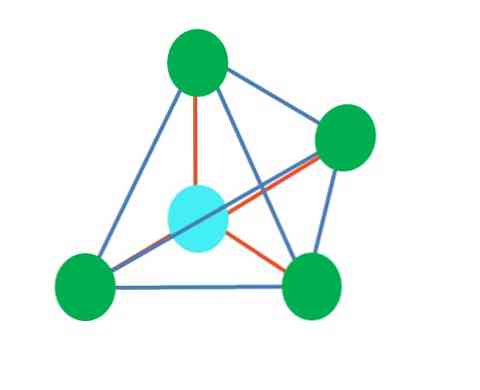
Den övre bilden representerar den tetrahedrala geometrin. För vattenmolekylen är dess elektroniska geometri tetrahedral, men genom att eliminera de elektronfria paren kan det noteras att det omvandlas till en vinkelgeometri. Detta observeras också helt enkelt genom att eliminera två gröna prickar; De återstående två kommer att dra V med den blå punkten.
Vad händer om istället för två par fria elektroner fanns det bara en? Då skulle det finnas ett trigonalplan (huvudbild). Genom att eliminera en elektronisk grupp undviks emellertid inte den steriska effekten som produceras av paret av fria elektroner. Därför snedvrider det trigonalplanet till en triangulär baspyramid:

Trots att den trigonala och tetraedriska pyramidmolekylgeometrin är olika, är den elektroniska geometrin densamma: tetrahedral. Så den trigonala pyramiden räknas inte som elektronisk geometri?
Svaret är nej, eftersom det är en produkt av den förvrängning som orsakas av "ögonloben" och dess steriska effekt, och denna geometri tar inte hänsyn till senare snedvridningar.
Av detta skäl är det alltid viktigt att först bestämma den elektroniska geometrin med hjälp av Lewis-strukturer innan den definierar molekylär geometri. Ammoniakmolekylen, NH3, är ett exempel på molekylär geometri för trigonalpyramid, men med tetrahedral elektronisk geometri.
Trigonal bipyramid
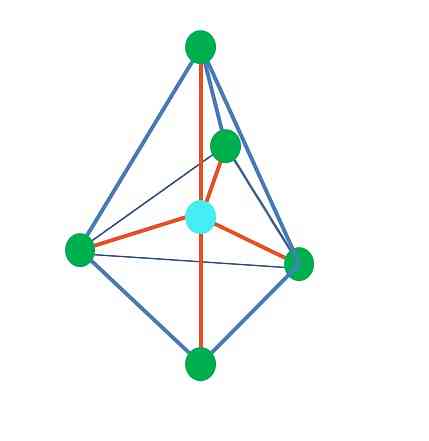
Hittills har, med undantag för linjär geometri, i den tetrahedrala, den vinkliga och den trigonala pyramiden, dess centrala atomer sp hybridisering3, enligt TEV. Detta innebär att om dina länkvinklar bestämdes experimentellt borde de vara omkring 109º.
Från trigonal dipiramidal geometri finns fem elektroniska grupper runt den centrala atomen. I den övre bilden kan du se med de fem gröna punkterna; tre i den triangulära basen och två i axiella positioner, vilka är pyramidens övre och nedre hörn.
Vilken hybridisering har då den blå pricken? Det behöver fem hybrid orbitaler för att bilda de enkla bindningarna (orange). Detta uppnås genom de fem sp orbitalerna3d (produkt av blandningen av en orbital s, tre p och a d).
När man överväger fem elektroniska grupper är geometrin den som redan är utsatt, men med elektronpar utan att dela, lider den här förvrängningar som genererar andra geometrier. Dessutom uppstår följande fråga: Kan dessa par uppta någon position i pyramiden? Dessa är: den axiella eller ekvatoriella.
Axiella och ekvatoriella positioner
De gröna punkterna som utgör den triangulära basen är i ekvatoriala positioner, medan de två i övre och nedre änden, i axiella positioner. Där kommer företrädesvis paret av elektroner utan delning att vara beläget? I den positionen minimeras elektrostatisk repulsion och sterisk effekt.
Axiellt lokalisera paret av elektroner skulle "tryck" vinkelrätt (90) på den triangulära basen, medan om i ekvatoriell position, de två återstående elektroniska grupper av basen skulle vara 120 ° från varandra och skulle pressa de två ändarna 90 ° (i stället för tre, som med basen).
Därför försöker den centrala atomen att orientera sina elektronfria par i ekvatoriella positioner för att generera mer stabila molekylgeometrier.
Oscillerande och T-form
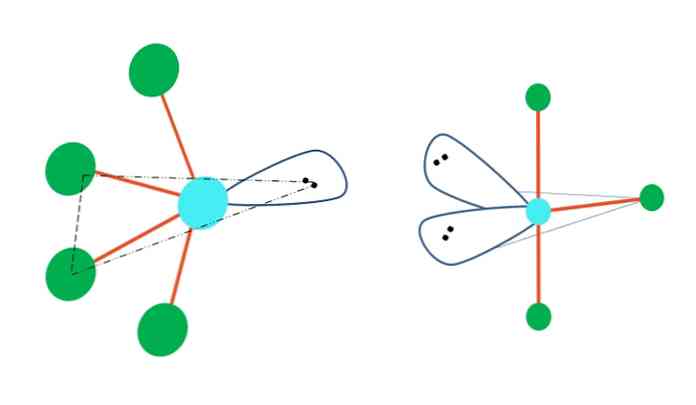
Om den trigonala bipyramidgeometrin skulle ersätta en eller flera av dess atomer med elektronfria par skulle den också ha olika molekylära geometrier.
Till vänster om toppbilden ändras geometrin till den oscillerande formen. I det trycker det fria paret elektroner resten av de fyra atomen i samma riktning och vikar sina länkar till vänster. Observera att detta par och två av atomer ligger i samma triangulära plan av den ursprungliga dipyramiden.
Och höger om bilden, den T-formade geometrin Denna molekyl geometri är resultatet av ersättning av två atomer av två par av elektroner, vilket följaktligen resulterar i de återstående tre atomer är inriktade i samma plan, exakt bildar en bokstav T.
Så, för en molekyl av typ AB5, det antar trigonal bipyramid geometri. Men AB4, med samma elektroniska geometri kommer den att anta den oscillerande geometrin; och AB3, Den T-formade geometrin. I alla av dem kommer A kommer att ha (generellt) sp hybridisering3d.
För att bestämma molekylär geometri är det nödvändigt att rita Lewis-strukturen och därmed dess elektroniska geometri. Om detta är en trigonal bipyramid, kommer de elektronfria paren att kasseras, men inte deras steriska effekter på resten av atomerna. Det är således möjligt att skilja perfekt mellan de tre möjliga molekylära geometrierna.
oktaedriska
Den oktaedriska molekylgeometrin representeras till höger om huvudbilden. Denna typ av geometri motsvarar AB-föreningarna6. AB4 de bildar kvadratbasen, medan de återstående två B är placerade i axiella positioner. Således bildas flera liksidiga trianglar, vilka är oktavans ansikten.
Här kan det igen finnas (som i alla elektroniska geometrier) fria elektronpar, och därför kommer andra molekylära geometrier härrör från detta faktum. Till exempel AB5 med oktaedisk elektronisk geometri består av en pyramid med kvadratbas och AB4 av ett fyrkantigt plan:
För fallet med oktaedisk elektronisk geometri är dessa två molekylära geometrier de mest stabila i termer av elektrostatisk repulsion. I kvadratisk geometri är de två elektronparen 180 ° från varandra.
Vad är hybridiseringen för atom A i dessa geometrier (eller strukturer, om det är den enda)? Återigen fastställer TEV att det är sp3d2, sex hybrid orbitaler, som tillåter A att orientera elektroniska grupper vid en octahedrons spetsar.
Andra molekylära geometrier
Genom att modifiera baserna av de hittills nämnda pyramiderna kan vissa mer komplexa molekylära geometrier erhållas. Exempelvis är den femkantiga bipyramiden baserad på en pentagon och föreningarna som bildar den har en allmän formel AB7.
Precis som de andra molekylära geometrierna, kommer att ersätta geometrin med andra B-atomer för elektronfria par.
Även AB-föreningarna8 De kan anta geometrier som kvadratisk antipris. Vissa geometrier kan vara mycket komplicerade, speciellt för AB-formuleringar7 framåt (upp till AB12).
exempel
Därefter kommer en serie föreningar att nämnas för varje huvudmolekylgeometri. Som en övning kan du rita Lewis-strukturerna för alla exemplen och intyga om du, med tanke på den elektroniska geometrin, får de molekylära geometrier som anges nedan..
Linjär geometri
-Etylen, H2CH2
-Berylliumklorid, BeCl2 (Cl-Be-Cl)
-Koldioxid, CO2 (0 = C = 0)
-Kväve, N2 (N≡N)
-Kvicksilverdibromid, HgBr2 (Br-Hg-Br)
-Aniontriiodid, I3- (I-I-I)
-Hydrogencyanid, HCN (H-N = C)
Vinklarna måste vara 180º och har därför sp hybridisering.
Vinkelgeometri
-Vattnet
-Svaveldioxid, SO2
-Kvävedioxid, NO2
-Ozon, O3
-Anion amiduro, NH2-
Trigonalplanet
-Bromtrifluorid, BF3
-Aluminiumtriklorid, AlCl3
-Nitratanjon, NO3-
-Anionkarbonat, CO32-
tetraedrisk
-Metangas, CH4
-Koltetraklorid, CCl4
-Katjonammonium, NH4+
-Anionsulfat, SO42-
Trigonal pyramid
-Ammoniak, NH3
-Katjonhydronium, H.3O+
Trigonal bipyramid
-Fosforpentafluorid, PF5
-Antimon Pentachlorid, SbF5
oscillerande
Svaveltetrafluorid, SF4
Form av T
-Jodtriklorid, ICl3
-Klortrifluorid, ClF3 (båda föreningarna är kända som interhalogener)
oktaedriska
-Svavelhexafluorid, SF6
-Selenhexafluorid, SeF6
-Hexafluorofosfat, PF6-
För att kulminera är molekylär geometri det som förklarar observationerna av materiens kemiska eller fysiska egenskaper. Det är emellertid orienterat enligt den elektroniska geometrin, så att den senare alltid måste bestämmas före den första.
referenser
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan). CENGAGE Learning, sid 194-198.
- Shiver & Atkins. (2008). Oorganisk kemi (Fjärde upplagan, sid 23, 24, 80, 169). Mc Graw Hill.
- Mark E. Tuckerman. (2011). Molekylär geometri och VSEPR-teorin. Hämtad från: nyu.edu
- Virtual Chembook, Charles E. Ophardt. (2003). Introduktion till molekylär geometri. Hämtad från: chemistry.elmhurst.edu
- Kemi LibreTexts. (8 september 2016). Molekylernas geometri. Hämtad från: chem.libretexts.org


