Egenskaper för natriumdikromat, produktion, faror och användningsområden
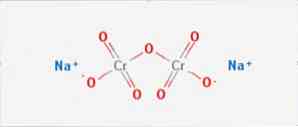
den natriumdikromat är en oorganisk förening med formeln Na2Cr207. Det är en av många hexavalenta kromföreningar (Cr VI). Dess struktur illustreras i figur 1, men vanligtvis hanteras saltet i dess dihydratiserad form, vars formel skulle vara Na2Cr2O7 · H2O.
Den har två jonbindningar mellan natriummolekylerna och de negativt laddade syrgaserna. Krommalmen extraheras från natriumdikromat. Miljoner kilo natriumdikromat produceras årligen.
Kina är den största producenten av natriumdikromat, men kinesiska kemiska fabriker har en relativt låg produktion, mindre än 50.000 ton per år vardera, jämfört med Kazakstan anläggning som producerar mer än 100.000 ton per år.
Växter i Ryssland, Förenta staterna och Förenade kungariket har en mellanproduktion mellan 50 000 och 100 000 ton per år (Kogel, 2006).
I termer av reaktivitet och utseende, har natriumdikromat liknande egenskaper kaliumdikromat, emellertid är mer löslig i vatten av natriumsaltet och har en ekvivalentvikt till kaliumsaltet.
Natriumdikromat ger giftiga kromångor vid uppvärmning. Det är ett starkt oxidationsmedel och är mycket frätande.
Denna förening kan hittas i dricksvattenkällor förorenade av olika industriella processer, såsom galvanisering eller elektropläteringsteknik, läder garvning och textilframställning.
index
- 1 Fysikaliska och kemiska egenskaper
- 2 Produktionsmetoder
- 3 Reaktivitet och faror
- 4 Användningar och applikationer
- 5 Biochemistry
- 6 referenser
Fysikaliska och kemiska egenskaper
Natriumdikromat består av kristaller med en rödaktig orange monoklinisk struktur i sin vattenfria och luktfria form. Dess molekylvikt är 261,97 g / mol i vattenfri form och 298,00 g / mol i dess dihydratiserad form.
Den har en smältpunkt av 356,7 grader Celsius, en kokpunkt på 400 grader Celsius där den sönderdelas. Den har en densitet av 2,52 g / ml.

Figur 2 visar utseendet av natriumdikromat. Dess löslighet i vatten är 187 g per 100 gram vid 25 grader Celsius och dess löslighet i etanol är 513,2 gram per liter till 19,4 grader Celsius (National Center for Biotechnology Information, S. F.).
Det anses vara en stabil förening om den förvaras under de rekommenderade förhållandena och är inte brandfarligt. Eftersom det är ett starkt oxidationsmedel är det frätande och i lösning är det surt med förmågan att sänka pH till 4 i en lösning av 1% vikt / volym.
Produktionsmetoder
Natriumkromat kan omvandlas till dikromat genom en kontinuerlig process som behandlar med svavelsyra, koldioxid eller en kombination av dessa två.
Indunstning av natriumdikromat vätskan orsakar utfällning av natriumsulfat och / eller natriumvätekarbonat, och dessa föreningar avlägsnas före den slutliga kristallisationen av natriumdikromat.
Natriumdikromat kan göras i en trestegsprocess:
- Alkalisk rostning av kromitoxidationsbetingelser
- Urlakning. Extraktion av lösligt material från en blandning genom verkan av ett flytande lösningsmedel
- Omvandling av natriummonokromat i natriumdikromat med hjälp av en syra.
Vattenfri natriumdikromat, kan framställas genom smältning av natriumdikromat-dihydrat, kristalliserande vattenlösningar av dikromat ovan 86 grader C, eller torknings lösningar av natriumdikromat i spraytorkare.
Natriumdikromat lösningar vid 69 och 70% vikt / volym används som en praktisk och kostnadseffektiv metod för att skicka mängder, undvika behovet av manuell hantering eller upplösning av kristaller.
Reaktivitet och faror
Det är ett starkt oxidationsmedel. Oförenlig med starka syror. Kontakt med brännbara material kan orsaka bränder. Giftiga ångor av kromoxid kan bildas i närvaro av värme eller eld.
Den kända "kromsyrablandningen" av dikromat och svavelsyra med organiska rester ger upphov till en våldsam exoterm reaktion. Denna blandning i kombination med acetonrester leder också till en våldsam reaktion.
Kombinationen av dikromat och svavelsyra med alkoholer, etanol och 2-propanol ger upphov till en våldsam exoterm reaktion. På grund av förekomsten av många incidenter med blandning av dikromat-svavelsyra med oxiderbara organiska material är det troligtvis bäst att undvika sådana interaktioner.
Kombinationen av dikromat med hydrazin är explosiv, dikromatreaktionen kan förväntas vara kraftig med aminer i allmänhet. Tillsatsen av det dehydrerade dikromatsaltet till ättiksyraanhydrid leder till en slutligen explosiv exoterm reaktion.
Bor, kisel och dikromater bildar pyrotekniska blandningar. En blandning av ättiksyra, 2-metyl-2-pentenal och dikromat leder till en rampant reaktion (Chemical Data Sheet Sodium Dichromate., 2016).
Inandning av damm eller dimma orsakar irritation i andningsorganen som ibland liknar astma. Septal perforering kan inträffa. Det anses vara gift.
Förtäring orsakar kräkningar, diarré och, mycket ovanligt, komplikationer i mage och njure. Kontakt med ögon eller hud orsakar lokal irritation. Upprepad exponering för huden orsakar dermatit.
Natriumdikromat är ett cancerframkallande ämne hos människor. Det finns bevis för att sexvärda kromföreningar eller Cr (VI) kan orsaka lungcancer hos människor. Det har visats att natriumdikromat orsakar lungcancer hos djur.
Medan natriumdikromat inte har identifierats som en teratogen förening eller reproduktiv risk är det känt att föreningar av sexvärt krom Cr (VI) är teratogener och orsaka reproduktiv skada och minska fertiliteten och störa menstruationscykler.
Natriumdikromat kan orsaka lever- och njurskador, så det måste hanteras med stor omsorg (New Jersey Department of Health, 2009).
Vid intagning ska offeret dricka vatten eller mjölk. Framkalla aldrig kräkningar. Vid kontakt med hud eller ögon ska det behandlas som sura brännskador. Skölj dina ögon med vatten i minst 15 minuter.
Externa skador kan gnidas med en 2% lösning av natriumtiosulfat. I alla fall bör en läkare konsulteras.
Användningar och applikationer
Bortsett från dess betydelse vid tillverkningen av andra kromkemikalier har natriumdikromat också många direkta användningsområden som en ingrediens i produktionen av:
- Metallisk ytbehandling: hjälper korrosionsbeständigheten och rengör metallytorna, vilket också gynnar färgens vidhäftning.
- Ekologiska produkter: används som oxidationsmedel vid tillverkning av produkter som vitamin K och vax.
- Pigment: Används vid tillverkning av oorganiska krompigment där det producerar ett antal färger stabila mot ljus. Vissa grader av kromat används också som korrosionshämmare i de nedre lager och primrar.
- Keramik: används vid framställning av färgade glasögon och keramiska glasyrer.
- Textil: används som en mordant för sura färgämnen för att förbättra sina snabbfärgningsegenskaper.
- Produktion av kromsulfat.
(Natriumdikromat, Byggstenen för praktiskt taget alla andra kromföreningar., 2010-2012)
Natriumdikromat Dihydrat, dess användning är idealisk under olika förhållanden, inklusive högtemperaturapplikationer, såsom keramiska glasyrer och färgat glas.
Kromoxid, som är hårdare än andra metalloxider, såsom titan eller järn, är idealisk för miljöer där temperatur och processförhållanden är aggressiva.
Detta ämne används främst för att framställa andra föreningar av krom, men används även i bentonit uppslamning användes i oljeproduktion, i träskyddsmedel, vid framställning av organiska kemikalier och som korrosionsinhibitor.
När den blandas med aluminium- och kaliumdikromat, med användning av den alumino-termiska processen, bildar kromoxiden hög metallisk krom. Detta är en viktig ingrediens i produktion av högpresterande superlegeringar som används inom rymdindustrin.
I organisk syntes används natriumdikromat som ett oxidationsmedel i reduktionsoxidreaktioner i närvaro av svavelsyra.
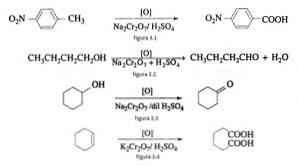
Till exempel oxidationen av p-nitrotoluen till bildande av p-nitrobensoesyra, vid oxidationen av n-butanol för att bilda n-butaldehido, vid bildningen av cyklohexanon från cyklohexanol och bildandet av adipinsyra såsom illustreras i fig 3.1 , 3,2, 3,3 respektive 3,4 (VK Ahluwalia, 2004).
biokemi
Intratrakeal instillation av natriumdikromat (CrVI) och kromacetat hydroxid (CrIII) i hanråttor resulterade i ökade koncentrationer av krom är helblod, plasma och urin upp till 72 timmar efter exponering; Maximal koncentration uppnåddes 6 timmar efter exponering.
Förhållandet mellan helblodkrom och plasmakromkoncentrationer var signifikant olika för Cr (VI) och Cr (III) behandlingarna. Därför bör analyser av krom i blod och krom i plasma användas för utvärdering av kromexponering.
Krom detekterades även i perifera lymfocyter. Cr (VI), men inte Cr (III) ackumulerades signifikant i lymfocyter efter behandling. Dessa celler har potential att användas som biomarkörer vid utvärderingen av exponering för kromföreningar (Hooth, 2008).
referenser
- Kemiskt datablad Natriumdikromat. (2016). Hämtad från cameo kemikalier: cameochemicals.noaa.
- Hooth, M.J. (2008). Teknisk rapport om toxicologi och cancerframkallande studier av natriumdikromat dihydrated. National Institute of Health USA.
- Kogel, J.E. (2006). Industriella mineraler och stenar: Varor, marknader och användningar sjunde upplagan. littleton colorado: samhället av gruvdrift, metallurgi och utforskning inc.
- National Center for Biotechnology Information. (N.D.). PubChem Compound Database; CID = 25408. Hämtad från pubchem.com: pubchem.ncbi.nlm.nih.gov.
- New Jersey Department of Health. (2009, november). Hazardous Substance Fact Sheet Natriumdikromat. Hämtat från nj.gov: nj.gov.
- Natriumdikromat. Byggstenen för praktiskt taget alla andra kromföreningar. (2010-2012). Hämtat från elementskrom: elementischromium.com
- K. Ahluwalia, R.A. (2004). Omfattande praktisk organisk kemi: Förberedelser och kvantitativa analyser. Delhi: Universitetspress (Indien).


