Exoterm reaktionsprocess, typer och exempel
den exoterm reaktion är en typ av kemisk reaktion i vilken en energiöverföring sker, huvudsakligen i form av värme eller lätt frisättning. Namnet kommer från det grekiska prefixet exo, vilket betyder "utomlands" och termen "termisk", som avser värme eller temperatur.
Här, kan de exoterma reaktionerna överföra andra typer av energi i mediet där den genereras, som med explosioner, och hur man överför kinetisk och ljudenergi när de ämnen som finns i gasfasen vid förhöjda temperaturer är expanderade våldsamt sätt.
På samma sätt, vid användning av batterier, utförs en exoterm reaktion, endast i detta fall transporteras elektrisk energi.
index
- 1 Process
- 2 typer
- 2.1 Förbränningsreaktioner
- 2.2 Neutraliseringsreaktioner
- 2.3 Oxideringsreaktioner
- 2.4 Termitreaktion
- 2,5 Reaktionspolymerisation
- 2.6 Kärnfissionreaktion
- 2.7 Andra reaktioner
- 3 exempel
- 4 referenser
process
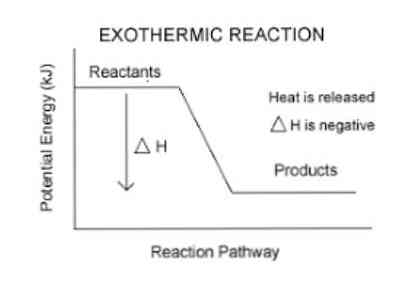
Tidigare nämndes att när en exoterm reaktion inträffar sker en energifrisättning som lättare kan visualiseras i följande ekvation:
Reagens (er) → Produkt (er) + Energi
Så, för att kvantifiera den energi som absorberas eller släpps av ett system används en termodynamisk parameter som kallas entalpi (betecknad med "H"). Om det i ett system (i det här fallet en kemisk reaktion) finns energiutsläpp till omgivningen, kommer variationen av enthalpi (uttryckt som Ah) att ha ett negativt värde.
Annars, om variationen av denna åtgärd är positiv, speglar den upptaget av värme från omgivningen. Också storleken av entalpivariationen hos systemet är ett uttryck för den mängd energi som överförs till eller från miljön.
Ju större storleken på ΔH desto större är utsläpp av energi från systemet till omgivande medium.
Detta beror på att i dessa reaktioner är den nettoenergi som släpps när nya länkar skapas större än den nettoenergi som används vid fragmentering av länkarna.
Av det ovanstående kan man dra slutsatsen att denna klass av reaktioner är mycket vanligt, eftersom reaktionsprodukterna har en mängd av energi som är lagrad i länkarna är större än den som ingår i reaktanterna inledningsvis.
Typ
Det finns olika typer av exoterma reaktioner inom olika kemiområden, vare sig i laboratoriet eller i industrin. vissa utförs spontant och andra behöver specifika betingelser eller någon typ av substans, såsom en katalysator som skall framställas.
Följande är de viktigaste typerna av exoterma reaktioner:
Förbränningsreaktioner
Förbränningsreaktioner är de, redoxtyp som inträffar när en eller flera substanser som reagerar med syre, vanligtvis för att resultera i frisättning av ljus och värme energi som är, värme- och ljus att inträffa en låga.
Neutraliseringsreaktioner
Neutraliseringsreaktioner karakteriseras av interaktionen mellan en surart och en alkalisk substans (bas) för att bilda ett salt och vatten, vilket uppenbarar en exoterm natur.
Oxideringsreaktioner
Det finns många reaktioner av denna typ som visar ett exotermt beteende, eftersom oxidationen av syre orsakar utsläpp av en stor mängd energi, vilket uppstår vid oxidationen av kolväten..
Termitreaktion
Denna reaktion kan producera en temperatur av ca 3000 ° C och på grund av den höga affiniteten hos aluminiumpulver med ett stort antal metalloxider används den vid svetsning av stål och järn.
Polymeriseringsreaktion
Denna typ av reaktion är den som uppkommer när man omsätter ett antal kemiska arter som kallas monomerer, vilka är enheter som kombinerade när upprepas i kedjor för att bilda strukturer som kallas makromolekylära polymerer.
Kärnfissionreaktion
Denna process hänför sig till kärnans fördelning av en atom betraktad som tung - det vill säga med ett massnummer (A) större än 200 - för att producera fragment eller kärnor av mindre storlek med en mellanmassa.
I denna reaktion, där en eller flera neutroner bildas, frigörs en stor mängd energi eftersom kärnan med större vikt har en lägre stabilitet än sina produkter.
Andra reaktioner
Det finns andra mycket relevanta exotermiska reaktioner såsom dehydratisering av vissa kolhydrater genom reaktion med svavelsyra, absorptionen av vatten med natriumhydroxid exponeras utomhus eller oxidation av metallspecies i många korrosionsreaktioner.
exempel
Nedan följer några exempel på exoterma reaktioner, som producerar en variation av entalpy som har ett negativt värde på grund av att de släpper ut energi, som nämnts ovan..
Till exempel är förbränningen av propan en spontan exoterm reaktion:
C3H8(g) + 502(g) → 3CO2(g) + 4H2O (l)
Ett annat fall av exotermt beteende framgår av neutraliseringsreaktionen mellan natriumkarbonat och saltsyra:
NaHCOa3(ac) + HCl (ac) → NaCl (ac) + H2O (1) + CO2(G)
Oxidationen av etanol till ättiksyra som används i andningsgaserna presenteras också, vars fullständiga reaktion visas i följande ekvation:
3CH3CH2OH + 2K2cr2O7 + 8H2SW4 → CH3COOH + 2Cr (SO4)3 + 2K2SW4 + 11H2O
En annan klass av exoterm reaktion är den så kallade termitreaktionen, i vilken aluminium kombineras med en metalloxid, såsom exemplifieras nedan:
2Al (s) + Tro2O3(s) → Al2O3(er) + Fe (l)
Förutom de ovan beskrivna exemplen finns ett stort antal reaktioner som också anses vara exoterma, såsom sönderdelning av vissa organiska avfall för kompostering..
Den belyser också pigment oxidation luciferin genom luciferas enzymverkan för att producera den karakteristiska eldfluga bioluminescens, och till och med andning, bland andra reaktioner.
referenser
- Wikipedia. (N.D.). Exoterm reaktion. Hämtad från es.wikipedia.org
- BBC. (N.D.). Energianvändningar och reversibla reaktioner. Hämtad från bbc.co.uk
- Chang, R. (2007). Kemi, nionde upplagan. (McGraw-Hill).
- Walker, D. (2007). Kemiska reaktioner. Hämtad från books.google.co.ve
- Saunders, N. (2007). Exploring Chemical Reactions. Hämtad från books.google.co.ve


