Lag av Boyle-Mariotte historia, matematisk uttryck, exempel
Lagen om Boyle är det som uttrycker sambandet mellan trycket som utövas av eller på en gas och den volym som upptas av den; hålla konstant gasens temperatur, liksom dess kvantitet (antal mol).
Denna lag, tillsammans med den av Charles, Gay-Lussac, Charles och Avogadro, beskriver beteendet hos en idealisk gas; specifikt i en sluten behållare underkastad volymförändringar som utövas av en mekanisk kraft.
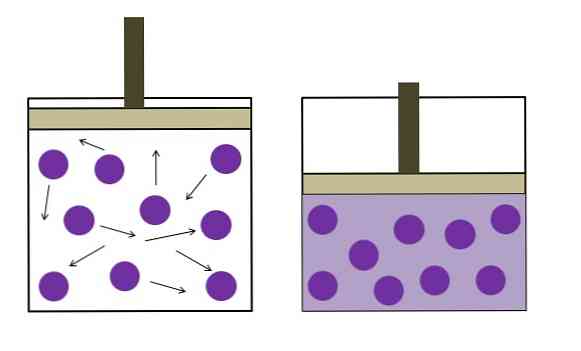
Bilden ovan är en kort sammanfattning av Boyle-Mariotte-lagen.
De lila prickarna representerar molekyler eller gasatomer som kolliderar med behållarens inre väggar (vänster). Genom att minska det tillgängliga utrymmet eller volymen hos behållaren som upptas av denna gas ökar kollisionerna, vilket innebär en ökning av trycket (höger).
Detta visar att trycket P och volymen V hos gasen är omvänd proportionella om behållaren är hermetiskt förseglad; annars skulle ett högre tryck vara lika med en större expansion av behållaren.
Om en plot V gjordes mot P, med data av V och P på respektive Y- och X-axlarna, skulle en asymptotisk kurva observeras. Ju mindre är V, desto större är ökningen i P; det vill säga att kurvan sträcker sig till höga värden på P på X-axeln.
Naturligtvis är temperaturen konstant; men om samma experiment utfördes vid olika temperaturer skulle de relativa lägena för dessa kurvor V vs P förändras i Cartesian-axeln. Förändringen skulle vara ännu tydligare om den plottades på en tredimensionell axel, med konstant T på Z-axeln.
index
- 1 History of Boyle's law
- 1.1 Bakgrund
- 1.2 Experiment med kvicksilver
- 1,3 Edme Mariotte
- 1.4 Förstärkning av lagen
- 2 Vad består denna lag av??
- 3 Matematiskt uttryck
- 4 Vad är det för? Vilka problem löser Boyles lag??
- 4.1 Ångmaskiner
- 4.2 Sipdrycker
- 4.3 Andningsorganen
- 5 Exempel (experiment)
- 5.1 Experiment 1
- 5.2 Experiment 2
- 6 referenser
Historia om Boyle's lag
bakgrund
Sedan forskaren Galileo Galilei uttryckte sin tro på existensen av tomhet (1638) började forskare att studera luftens och partiella tomrums egenskaper.
Den engelsk-irländska kemisten Robert Boyle började sin studie av luftfastigheter år 1638 när han fick veta att Otto von Guericke, en tysk ingenjör och fysiker, hade byggt en luftpump.
Experiment med kvicksilver
För att utföra sina studier av lufttryck använde Boyle ett glasrör i form av "J", vars konstruktion tillskrivs Robert Hooke, en assistent av Boyle. Änden på den korta armen var förseglad, medan änden på rörets långa arm var öppen för att placera kvicksilver.
Från början ville Boyle studera luftens elasticitet, kvalitativt och kvantitativt. Genom att hälla kvicksilver genom den öppna änden av det "J" -formade röret utlöste Boyle att luften i rörets korta arm sammandragit under kvicksilvertryck.
resultat
Ju större mängden kvicksilver som läggs till röret desto större är trycket på luften och ju lägre dess volym. Boyle erhöll en negativ exponentiell typgraf för luftvolymen som en funktion av tryck.
Om du plottar volymen av luften mot det motsatta trycket, har du en rak linje med positiv lutning.
År 1662 publicerade Boyle den första fysiska lagen som gavs i form av en ekvation, vilket indikerar det funktionella beroende av två variabler. I detta fall trycket och volymen.
Boyle påpekade att det var ett inverterat förhållande mellan trycket som utövades på en gas och volymen upptagen av den gasen, vilket förhållande var relativt sant för reella gaser. De flesta gaser beter sig som idealiska gaser vid måttliga tryck och temperaturer.
Med högre tryck och lägre temperaturer blev avvikelser från de verkliga gasernas uppförande av idealerna mer märkbara.
Edme Mariotte
French fysikern Edme Mariotte (1620-1684) upptäckte oberoende samma lag i 1679. Men haft fördelen av att visa att volymen varierar med temperaturen. Det är därför det heter Mariotte's Law eller Boyle och Mariotte's Law.
Förstärkning av lagen
Daniel Bernoulli (1737) stärkte Boyle's Law genom att påpeka att trycket från en gas produceras av gaspartiklarnas inverkan på behållarens väggar som innehåller den..
År 1845 publicerade John Waterston en vetenskaplig artikel där han fokuserar på huvudprinciperna för kinetisk teori om gaser.
Senare konsoliderade Rudolf Clausius, James Maxwell och Ludqwig Boltzmann den kinetiska teorin om gaser, vilket relaterar trycket som utövas av en gas med hastigheten hos gasens partiklar i rörelse.
Ju mindre volymen av behållaren som innehåller en gas, desto större är frekvensen för inverkan av partiklarna som bildar den mot behållarens väggar. och därför är ju större trycket som utövas av gasen.
Vad består denna lag av??
De experiment som utförs av Boyle påpekar att det finns ett omvänt förhållande mellan den volym som upptas av en gas och trycket som utövas på den. Emellertid är det ovannämnda förhållandet inte helt linjärt, vilket indikeras med ett diagram av volymvariation i enlighet med det tryck som tillskrivs Boyle.
I Boyle's Law påpekas att volymen upptagen av en gas är omvänd proportionell mot trycket. Det indikeras även att produkten av trycket av en gas med dess volym är konstant.
Matematiskt uttryck
För att komma till matematisk uttryck för Boyle-Mariotte-lagen börjar vi från:
V a 1 / P
Där det indikerar att volymen upptagen av en gas är omvänd proportionell mot dess tryck. Det finns emellertid en konstant som dikterar hur omvänt proportionellt detta förhållande är.
V = k / P
Där k är proportionalitetskonstanten. Clearing k du har:
VP = k
Produkten av trycket av en gas med dess volym är konstant. då:
V1P1 = k och v2P2 = k
Och härvid kan man härleda att:
V1P1 = V2P2
Den senare är det sista uttrycket eller ekvationen för Boyle's lag.
Vad är det för? Vilka problem löser Boyles lag??
Ångmaskiner

Boyle-Mariotte lagen gäller driften av ångmotorer. Det är en extern förbränningsmotor som använder omvandling av termisk energi från en mängd vatten till mekanisk energi.
Vattnet upphettas i en hermetiskt förseglad panna, och den ångproducerade utsugningen utövar ett tryck enligt Boyle-Mariote-lagen som ger en volymförlängning av en cylinder genom att trycka en kolv.
Kolvens linjära rörelse omvandlas till en rotationsrörelse genom användning av ett system med vev och vevar, som kan driva hjul på ett lokomotiv eller rotorn hos en elektrisk generator.
För närvarande är den alternativa ångmotorn en liten begagnad motor, eftersom den har förskjutits av elmotorn och förbränningsmotorn i transportfordon.
Nippar drycker
Åtgärden att suga en läsk eller juice från en flaska genom ett plaströr är relaterat till Boyle-Mariotte-lagen. När luften sugs från röret med munnen, är det en minskning av trycket inuti röret.
Detta tryckfall underlättar uppåtgående rörelse av vätskan i röret, vilket tillåter dess intagning. Samma princip fungerar vid utvinning av blod genom att använda en spruta.
Andningsorganen
Boyle-Mariotte lagen är intimt relaterad till luftvägarnas funktion. Under inspirationsfasen uppträder sammandragning av membranet och andra muskler; till exempel de externa mellankroppar som producerar en expansion av ribbburet.
Detta medför en minskning av intrapleuralt tryck, vilket medför en lungexpansion som ger en ökning av lungvolymen. Därför minskar det intrapulmonära trycket enligt vad som anges i Boyle-Mariotte-lagen.
När det intrapulmonära trycket är subatmosfäriskt, flyter den atmosfäriska luften in i lungorna, vilket leder till ökat tryck i lungorna. motsvarar sitt tryck mot atmosfärstrycket och avslutar inspirationsfasen.
Därefter slappar de inspiratoriska musklerna och de expiratoriska musklerna samman. Dessutom uppträder lungelastisk retraktion, ett fenomen som ger en minskning av lungvolymen, med en följdökning av intrapulmonalt tryck, vilket kan förklaras med Boyle-Mariotte-lagen..
Genom att öka intrapulmonalt tryck och bli större än atmosfärstrycket strömmar luften från lungans inre till atmosfären. Detta händer tills trycket utjämnas, vilket avslutar utgångsfasen.
Exempel (experiment)
Experiment 1
En liten ballong placeras tätt tillsluten, en knut i munnen, inuti en spruta, till vilken kolven har tagits bort, ca 20 ml. Kolven på sprutan placeras mot sprutans mittdel, nålen är borttagen och luftinloppet är hindrat.
observation
Genom att långsamt dra injektionsstångens kolv observeras att ballongen är uppblåst.
förklaring
Två påtryckningar utövas på ballongens vägg: ett tryck på dess inre yta, produkten av luften inne i ballongen och ett annat tryck på ballongens yttre yta som utövas av luften i sprutan.
När du drar injektorns kolv, skapas ett halvvakuum inuti det. Därför minskar lufttrycket på ytterväggen på pumpväggen, vilket gör trycket utövas inne i pumpen relativt större..
Detta nettotryck, enligt Boyle-Mariote-lagen, kommer att ge en distans av ballongväggen och en ökning av ballongvolymen.
Experiment 2
Klipp en plastflaska, ungefär i halv, så att klippet är så horisontellt som möjligt. I flaskans mun placeras en väljusterad ballong samtidigt som en viss mängd vatten placeras i en djup skål.
observation
Genom att placera botten av flaskan med ballongen på diskens vatten, uppblåses ballongen måttligt.
förklaring
Vattnet förskjuter en viss mängd luft, vilket ökar trycket i luften på flaskans vägg och ballongens inre. Detta medför, enligt Boyle-Mariots lag, en ökning av världens volym, som visualiseras av världens inflation.
referenser
- Wikipedia. (2019). Boyle's lag. Hämtad från: en.wikipedia.org
- Editors of Encyclopaedia Britannica. (27 juli 2018). Boyle's lag. Encyclopædia Britannica. Hämtad från: britannica.com
- Helmenstine, Todd. (5 december 2018). Formeln för Boyle's Law. Hämtad från: thoughtco.com
- Unga indiska filmer. (15 maj 2018). Boyle's Law: Science Experiment för barn. Hämtad från: yifindia.com
- Cecilia Bembibre (22 maj 2011). Varmluftsballong Definition ABC. Hämtad från: definicionabc.com
- Ganong, W, F. (2003). Medicinsk fysiologi (19: e upplagan). Redaktionell den moderna handboken.


