Magnesiumhydridformel, kemisk struktur och egenskaper
den magnesiumhydrid (MGH2 med molekylformeln), är en kemisk förening med viktinnehåll av väte av 7,66% och finns i naturen som ett vitt kristallint fastämne. Det används huvudsakligen för att förbereda andra kemiska ämnen, även om det också har studerats som ett potentiellt lagringsmedium för väte.
Det tillhör familjen (eller jon) salt hydrider, de som definieras av negativt laddade H- jon. Dessa hydrider anses sådana som bildas av alkalimetaller och alkaliska jordartsmetaller, men i fallet av magnesium (och beryllium) har kovalenta bindningar, jonisk additions till de som kännetecknar detta familje hydrider.
index
- 1 Framställning och formel
- 2 Kemisk struktur
- 3 Fysikaliska och kemiska egenskaper
- 3.1 Fysisk
- 3.2 Kemikalier
- 4 användningsområden
- 4.1 Väteförvaring
- 4.2 Reaktioner av hydrogenering och dehydrogenering
- 4.3 Mudder
- 4.4 Bränsleceller
- 4.5 Transport och energi
- 4.6 Alkylering
- 5 risker
- 5.1 Reaktion med vatten
- 5.2 Det är pyroforiskt
- 6 referenser
Framställning och formel
Magnesiumhydrid bildas genom direkt hydrogenering av magnesium (Mg) -metall under betingelser med högt tryck och temperatur (200 atmosfär, 500 ° C) med en MgI-katalysator2. Dess reaktion motsvarar:
Mg + H2→ MgH2
Produktionen av MgH har också undersökts2 vid lägre temperaturer med användning av nanokristallint magnesium producerat i kulkvarnar.
Det finns även andra metoder för framställning, men utgör mer komplexa kemiska reaktioner (hydrogenering av magnesium-antracen dietylmagnesium reaktionen mellan hydrid litiumaluminiumhydrid, och som en produkt av en komplex MGH2).
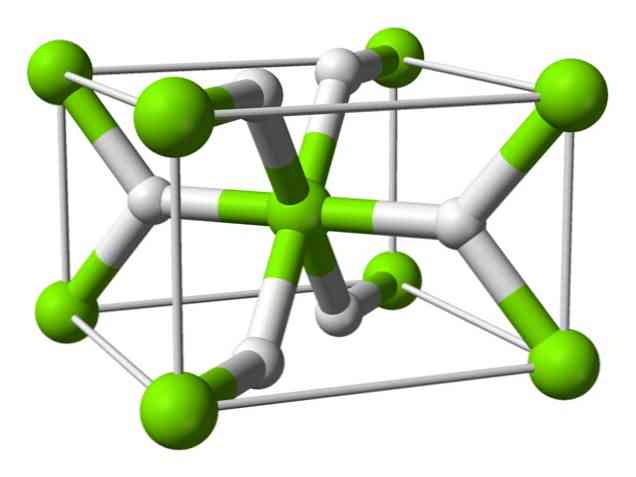
Kemisk struktur
Denna atom har en struktur av rutil vid rumstemperatur, med en tetragonal kristallin struktur. Den har åtminstone fyra olika former under höga tryckförhållanden, och en icke-stökiometrisk struktur med vätebrister har också observerats; sistnämnda sker endast i mycket små mängder partiklar när de bildas.
Såsom nämnts ovan har bindningarna som existerar i rutilstrukturen delvis kovalenta egenskaper istället för att vara rent joniska, som andra saltlösningar hydrider.
Detta medför att magnesiumatomen har en sfärisk form, helt joniserad, men dess hydridjon har en långsträckt struktur.
Fysikaliska och kemiska egenskaper
fysiskt
- Utseende: vita kristaller.
- Molmassa: 26,3209 g / mol
- Densitet: 1,45 g / cm3
- Smältpunkt: 285 ° C sönderdelas
- Löslighet: I vatten sönderdelas.
Denna kemiska förening har en molekylvikt av 26,321 g / mol, en densitet av 1,45 g / cm3 och har en smältpunkt av 327 ° C.
kemisk
- Föregångare för tillverkning av andra kemiska ämnen.
- Väteförvaring, som en möjlig energikälla.
- Reduktionsmedel i organisk syntes.
Det är viktigt att ange att denna förening inte kan bringas till flytande tillstånd, och när den bärs eller smältpunkten eller införs i vatten sönderdelas den. Denna hydrid är olöslig i eter.
Det är ett mycket reaktivt och mycket brandfarligt ämne, och det är också pyroforiskt, det vill säga det kan antända spontant i luften. Dessa tre villkor utgör säkerhetsrisker som kommer att nämnas i det sista avsnittet i denna artikel.
tillämpningar
Väteförvaring
Magnesiumhydrid reagerar lätt med vatten för att bilda vätegas genom följande kemiska reaktion:
MGH2+2H20 → 2H2+Mg (OH)2
Dessutom sönderdelas detta ämne vid en temperatur av 287 ° C och ett tryck på 1 bar, enligt följande:
MGH2→ Mg + H2
Därför har användningen av magnesiumhydrid som ett väteförvaringsmedium för dess användning och transport föreslagits.
hydrogenering och dehydrogenering av en mängd av metalliskt magnesium som ett sätt att transportera mängder vätgas uppstår, vilket garanterar inget läckage därav i transport och som representerar en säkrare och bekvämare sätt än med användning av högtryckskärl.
Hydrogenerings- och dehydrogeneringsreaktioner
Fastän sönderdelningstemperaturen för magnesiumhydrid representerar en begränsande faktor för dess användning har förfaranden föreslagits för att förbättra kinetiken för hydrerings- och dehydrogeneringsreaktioner. En av dessa är med minskningen av storleken av magnesiumpartikeln med användning av kulkvarnar.
lera
Det har också tagit upp ett system som producerar magnesiumhydrid som slam (mer hanterbar och säker på att pulver eller andra fasta partiklar), som skulle bringas att reagera med vatten för att erhålla den önskade väte.
Det uppskattas att den ovan nämnda slam skulle bestå av en fint malda hydrid, skyddas med ett skyddsskikt av oljor och suspenderades i dispergermedel för att se till att upprätthåller konsistens utan förlust av material, och som inte absorberar fukt.
Detta slam har fördelen att det kan pumpas genom en vanlig diesel-, bensin- eller vattenpump, vilket gör detta ekonomiska förslag såväl som effektivt.
Bränsleceller
Magnesiumhydrid kan implementeras vid framställning av avancerade bränsleceller, och även vid skapande av batterier och energilagring.
Transport och energi
Under de senaste årtiondena har användningen av väte som energikälla beaktats. Implantationen av väte som bränsle kräver att man hittar säkra och reversibla förvaringssystem och med hög volymkapacitet (mängd väte per volymenhet) och gravimetrisk (mängd väte per massa).
alkylering
Alkylering (tillsätt CH-alkylgrupper3R) av organiska föreningar i basmedium, där det finns närvaro av -OH-grupper vid låga koncentrationer och temperaturer som är högre än hydridens smältpunkt.
I detta fall är de väten närvarande i magnesiumhydrid (MgH2), förenar -OH-grupperna som bildar vatten. Fri magnesium kan få halogenet som ofta åtföljer alkylmolekylen som är avsedd att binda till kolvätekedjan.
risker
Reaktion med vatten
Som tidigare nämnts är magnesiumhydrid en substans som reagerar mycket lätt och våldsamt med vatten och presenterar förmågan att explodera vid högre koncentrationer.
Detta beror på att dess exoterma reaktion alstrar tillräckligt med värme för att antända vätgasen som släpptes i sönderdelningsreaktionen, vilket leder till en ganska farlig kedjereaktion..
Det är pyroforiskt
Magnesiumhydrid är också pyroforisk, vilket innebär att den kan antändas spontant i närvaro av fuktig luft och bildar magnesiumoxid och vatten.
Dess inandning rekommenderas inte i fast tillstånd eller i kontakt med dess ångor: ämnet i dess naturliga tillstånd och dess nedbrytningsprodukter kan orsaka allvarliga skador eller till och med dödsfall.
Det kan generera frätande lösningar i kontakt med vatten och förorening av det. Kontakt med huden och ögonen rekommenderas inte och genererar också irritation i slemhinnorna.
Det har inte visats att magnesium-hydrid kan generera kroniska hälsoeffekter såsom cancer, reproduktiva defekter eller andra fysiska eller psykiska konsekvenser, men användningen av skyddsutrustning rekommenderas vid hantering (särskilt andningsskydd eller masker, för deras fint dammkaraktär).
Vid arbete med detta ämne måste luftfuktigheten hållas på låga nivåer, släcka alla antändningskällor och transportera den i trummor eller andra behållarbehållare..
Du bör alltid undvika att arbeta med stora koncentrationer av detta ämne när det kan undvikas, eftersom risken för explosion minskar avsevärt.
Om ett spill av magnesiumhydrid uppstår ska arbetsområdet isoleras och dammet uppsamlas med en dammsugare. Du bör aldrig använda den torra sopningsmetoden. ökar chanserna för en reaktion med hydrid.
referenser
- Zumdahl, S. S. (1998). Encyclopedia Britannica. Hämtad från britannica.com.
- PubChem. (2005). PubChem Open Chemistry Database. Hämtad från pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). Green Car Congress. Hämtad från greencarcongress.com.
- Chemicals, C. (n.d.). Cameo Chemicals. Hämtad från cameochemicals.noaa.gov.
- Services, N.J. (1987). New Jersey Department of Health och Senior Services. Hämtad från nj.gov.


