Etanstruktur, egenskaper, användningar och risker
den etan är ett enkelt kolväte med formel C2H6 med en typ av färglös och luktfri gas som har en mycket värdefull och diversifierad användning vid syntesen av etylen. Dessutom är det en av de jordgaser som också har detekterats i andra planeter och stjärnkroppar runt solsystemet. Det upptäcktes av forskaren Michael Faraday år 1834.
Bland det stora antal organiska föreningar som utgörs av kolatomer och väte (känd som kolväten), finns det de som är i gasformigt tillstånd vid omgivande temperaturer och tryck, som används i talrika industrier kraftigt.
Dessa kommer vanligen från den gasformiga blandningen som kallas "naturgas", en produkt av högt värde för mänskligheten och bland annat metan, metan, etan, propan och butan. klassificeras i enlighet med mängden kolatomer i dess kedja.
index
- 1 Kemisk struktur
- 1.1 Syntes av etan
- 2 egenskaper
- 2.1 Löslighet av etan
- 2.2 Kristallisation av etan
- 2.3 Förbränning av etan
- 2.4 Etan i atmosfären och i himmellegemer
- 3 användningsområden
- 3.1 Etylenproduktion
- 3.2 Utbildning av grundläggande kemikalier
- 3.3 Köldmedium
- 4 Risker för etan
- 5 referenser
Kemisk struktur
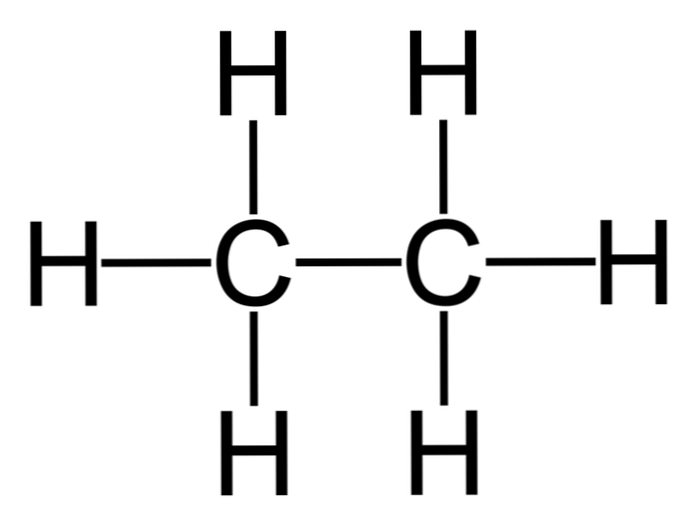
Etan är en molekyl med formel C2H6, typiskt sett som en fackförening av två metylgrupper (-CH3) för att bilda kolväten i en enkel kol-kol-bindning. Det är också den enklaste organiska föreningen efter metan, representerad enligt följande:
H3C-CH3
Kolatomerna i denna molekyl har sp-hybridisering3, så de molekylära bindningarna uppvisar fri rotation.
Också, det är en inneboende fenomen av etan, vilket är baserat på rotationen av den molekylära strukturen därav och den minimala energi som krävs för att producera en rotation av länken 360, som forskarna har namnet "barriär etan".
Av detta skäl kan etan förekomma i olika konfigurationer beroende på dess rotation, även om dess mer stabila konformation existerar där vätena är motsatta varandra (som visas i figuren).

Syntes av etan
Etan kan lätt syntetiseras från Kolbe elektrolys, en organisk reaktion i vilken två steg inträffar: en elektrokemisk dekarboxylering (avlägsnande av karboxylgruppen och frisättning av koldioxid) av två karboxylsyror, och kombinationsprodukter intermediärer för att bilda en kovalent bindning.
På liknande sätt leder elektrolysen av ättiksyra till bildandet av etan och koldioxid, och denna reaktion används för att syntetisera den första.
Oxidation av ättiksyraanhydrid genom inverkan av peroxider, resulterar en liknande den Kolbe elektrolys konceptet också i bildningen av etan.
På samma sätt kan den effektivt separeras från naturgas och metan genom en flytande process, med hjälp av kryogena system för att fånga denna gas och separera den från blandningar med andra gaser..
Turboexpansionprocessen är att föredra för denna roll: gasblandningen passerar genom en turbin som alstrar en expansion därav tills dess temperatur sjunker under -100ºC.
Redan vid denna punkt kan vara differentierade komponenter i blandningen, så att vätska metan och etan gaser andra arter involverade med användningen av ett separat destillation.
egenskaper
Etan förekommer i naturen som en luktfri och färglös gas vid standardtryck och temperaturer (1 atm och 25 ° C). Den har en kokpunkt på -88,5 ºC och en smältpunkt på -182.8 ºC. Dessutom påverkas det inte av exponering för starka syror eller baser.
Etanololöslighet
Etans molekyler är av symmetrisk konfiguration och har svaga dragningskraftar som håller dem ihop, kallade spridda krafter.
När etan försöks att lösas i vatten är attraktionskrafterna mellan gasen och vätskan mycket svaga, så att det är mycket svårt att gå med i etan med vattenmolekyler.
Av denna anledning är lösligheten av etan avsevärt låg, vilket ökar något när systemtrycket stiger.
Kristallisation av etan
Etan kan stelas, vilket resulterar i bildning av instabila etankristaller med en kubisk kristallin struktur.
Med en temperaturminskning över -183,2 ° C blir denna struktur monoklinisk, vilket ökar stabiliteten hos molekylen.
Etanförbränning
Detta kolväte, även om det inte används allmänt som bränsle, kan användas vid förbränningsprocesser för att generera koldioxid, vatten och värme, vilket är representerat enligt följande:
2C2H6 + 7O2 → 4CO2 + 6H2O + 3120 kJ
Det är också möjligt att bränna denna molekyl utan överskottssyre, som är känd som "ofullständig förbränning" och resulterar i bildning av amorft kol och kolmonoxid i en oönskad reaktion som syreingångs :
2C2H6 + 3O2 → 4C + 6H2O + Värme
2C2H6 + 4O2 → 2C + 2CO + 6H2O + Värme
2C2H6 + 5O2 → 4CO + 6H2O + Värme
I detta område sker förbränning genom en rad reaktioner i fri radikal, som är nummererade i hundratals olika reaktioner. Exempelvis kan föreningar såsom formaldehyd, acetaldehyd, metan, metanol och etanol bildas i ofullständiga förbränningsreaktioner..
Detta beror på de förhållanden under vilka reaktionen uppträder och de involverade fria radikale reaktionerna. Etylen kan också bildas vid höga temperaturer (600-900 ºC), vilket är en produkt som är mycket önskad av industrin.
Etan i atmosfären och himmelska kroppar
Etan är närvarande i jordens atmosfär i spår och man misstänker att människan har lyckats fördubbla denna koncentration sedan han började träna industriella aktiviteter.
Forskare tror att mycket av den nuvarande närvaron av etan i atmosfären på grund av förbränning av fossila bränslen, även om de globala utsläppen av etan har minskat med nästan halv eftersom produktionsteknik av skiffergas förbättrades (en naturgaskälla).
Denna art produceras också naturligt av effekten av solstrålar på atmosfärisk metan, som rekombinerar och bildar en molekyl av etan.
Etan finns i flytande tillstånd på ytan av Titan, en av Saturns månar. Detta sker i större mängd i floden Vid Flumina, som strömmar mer än 400 kilometer mot en av dess hav. Det har också bevisats denna förening på kometer, och på Pluto-ytan.
tillämpningar
Etylenproduktion
Användningen av etan baseras huvudsakligen på produktion av eten, den mest använda organiska produkten i världsproduktionen, genom en process som kallas ångkrackning..
Denna process består av att mata etan av etan utspätt med ånga till en ugn, värma det snabbt utan syre.
Reaktionen sker vid en mycket hög temperatur (mellan 850 och 900 ° C), men uppehållstiden (tid i ugnen etan) bör vara kort för att reaktionen skall vara effektiv. Vid högre temperaturer genereras mer etylen.
Utbildning av grundläggande kemikalier
Etan har också studerats som en huvudkomponent i bildandet av grundläggande kemikalier. Oxidativ klorering är en av de processer som föreslås för att erhålla vinylklorid (en komponent av PVC), som ersätter billigare och mer komplicerade.
kylmedel
Slutligen används etan som ett kylmedel i vanliga kryogena system, vilket också visar förmågan att frysa små prov i laboratoriet för analys.
Det är ett mycket bra substitut för vatten, vilket tar längre tid att kyla de känsliga proven, och kan också generera bildandet av skadliga iskristaller.
Etan riskerar
-Etan har förmåga att antända, speciellt när det binder med luft. Vid procentandelar av 3,0 till 12,5 volymprocent etan i luften kan en explosiv blandning bildas.
-Det kan begränsa syre i luften där den finns och av den anledningen utgör den en riskfaktor för kvävning för människor och djur som är närvarande och utsatta.
-Etan i frusen vätskeform kan bränna huden kraftigt om den kommer i direkt kontakt med den och också fungera som ett kryogent medium för föremål som det rör sig om, fryser det i ögonblick.
-Flytande etan ångor är tyngre än luft och är koncentrerade på marken, kan detta medföra risk för antändning, som kan alstra en förbränningsreaktion kedja.
-Intag av etan kan orsaka illamående, kräkningar och inre blödningar. Inandning, förutom kvävning, orsakar huvudvärk, förvirring och humörsvängningar. Död på grund av hjärtstopp är möjlig vid höga exponeringar.
-Det representerar en växthusgas som tillsammans med metan och koldioxid bidrar till global uppvärmning och klimatförändringar som orsakas av mänsklig förorening. Lyckligtvis är det mindre rikligt och hållbart än metan, och absorberar mindre strålning än detta.
referenser
- Britannica, E. (s.f.). Etan. Hämtad från britannica.com
- Nes, G. V. (s.f.). Enkristallstrukturer och elektrondensitetsfördelningar av etan, etylen och acetylen. Återställd från rug.nl
- Sites, G. (s.f.). Etan: Källor och diskhoar. Hämtad från sites.google.com
- SoftSchools. (N.D.). Etanformel. Återställd från softschools.com
- Wikipedia. (N.D.). Etan. Hämtad från en.wikipedia.org


