Kemisk aktiveringsenergi Vad den består av, beräkning
den kemisk aktiveringsenergi (ur synvinkel av kinetiska studier) hänvisar till minsta möjliga mängd energi som krävs för att starta en kemisk reaktion. Enligt teorin om kollisioner i kemisk kinetik sägs att alla molekyler som är i rörelse har en viss mängd kinetisk energi.
Det innebär att ju större rörelsehastigheten desto större är din kinetiska energi. På så sätt kan en molekyl som bär en snabb rörelse inte splittras i fragment i sig, så det måste uppstå en kollision mellan den och en annan molekyl så att en kemisk reaktion kan uppstå.
När detta händer - när en kollision uppstår mellan molekylerna - omvandlas en bråkdel av sin kinetiska energi till vibrationsenergi. På samma sätt, om i början av processen den kinetiska energin är hög, kommer molekylerna som deltar i kollisionen att uppvisa en vibration så stor att några av de kemiska bindningarna som är närvarande kommer att brytas..
Denna brytning av länkar är det första steget i omvandlingen av reaktanter till produkter; det vill säga i bildandet av dessa. Å andra sidan, om kinetisk energi i början av denna process är av liten storlek, kommer det att finnas ett fenomen av "rebound" av molekylerna, genom vilka de kommer att separera praktiskt taget intakta..
index
- 1 Vad består det av??
- 1.1 Aktiverat komplex
- 2 Hur beräknas det?
- 2.1 Beräkning av aktiveringsenergin för en kemisk reaktion
- 3 Hur påverkar aktiveringsenergin reaktionshastigheten?
- 4 Exempel på beräkning av aktiveringsenergi
- 5 referenser
Vad består det av??
Med utgångspunkt från begreppet kollisioner mellan molekyler för att initiera de tidigare beskrivna kemiska reaktionerna kan det sägas att det finns en minimal mängd energi som krävs för att en kollision ska inträffa.
Så om energivärdet är mindre än detta nödvändiga minimum, kommer det helt enkelt inte att finnas några förändringar mellan molekylerna efter kollisionen, vilket innebär att när den här energin är frånvarande kvarstår de berörda arterna nästan intakta och kommer inte att hända någon förändring på grund av denna chock.
I denna idéordning är den minsta energi som behövs för en förändring som uppstår efter en kollision mellan molekyler kallad aktiveringsenergi.
Med andra ord måste molekylerna som är involverade i en chock ha en mängd total kinetisk energi med en magnitud lika med eller större än aktiveringsenergin så att en kemisk reaktion kan uppstå.
Även i många fall kolliderar molekylerna och härstammar en ny art som kallas aktiverat komplex, struktur som också kallas "övergångsstatus" eftersom det endast existerar tillfälligt.
Det orsakas av reaktantarten på grund av kollisionen och före bildningen av reaktionsprodukterna.
Aktiverad komplex
Det aktiverade komplexet som nämns ovan bildar en art som har mycket låg stabilitet men som i sin tur har en stor mängd potentiell energi.
Följande diagram visar omvandlingen av reaktanter till produkter, uttryckt i termer av energi och att notera att storleken av den energi aktiverade komplex som bildas är avsevärt högre än de reaktanter och produkter som observeras.
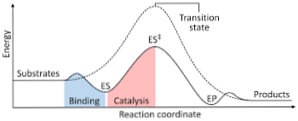
Om produkterna i reaktionens slut har en större stabilitet än reaktantämnena, uppträder frisättningen av energi i form av värme, vilket ger en exoterm reaktion..
Omvänt, om reaktanterna är en stabilitet av större magnitud än de produkter, betyder det att reaktionsblandningen visar en energiabsorption som värme från omgivningen, vilket resulterar endotermisk reaktion typ.
På samma sätt, om ett fall eller det andra inträffar, måste ett diagram konstrueras, såsom det som tidigare visats, där den potentiella energin i systemet som reagerar mot reaktionens framsteg eller framsteg planeras..
På detta sätt erhålles de potentiella energiförändringar som sker när reaktionen pågår, och reaktanterna omvandlas till produkter.
Hur beräknas det?
Aktiveringsenergin för en kemisk reaktion är intimt relaterad till hastighetskonstanten för den reaktionen och beroendet av denna konstant på temperaturen representeras av Arrhenius ekvationen:
k = Ae-Ea / RT
I detta uttryck k representerar reaktionens hastighetskonstant (som beror på temperaturen) och parametern EN det kallas frekvensfaktor, och det är ett mått på frekvensen av intermolekylkollisioner.
För sin del, och uttrycker grunden för serien av naturliga logaritmer. Den höjs till en kraft som är lika med aktiveringsenergins negativa kvot (Ea) mellan produkten som erhålles från gaskonstanten (R) och den absoluta temperaturen (T) av systemet att överväga.
Det bör noteras att frekvensfaktorn kan betraktas som en konstant i vissa reaktionssystem över ett brett temperaturområde.
Denna matematiskt uttryck gavs först av den nederländska födda kemist Jacobus Henricus van't Hoff 1884, men som gav vetenskapliga giltighet och tolkat sin premiss var den svenska kemisten Svante Arrhenius ursprung, 1889.
Beräkning av aktiveringsenergin för en kemisk reaktion
Arrhenius ekvationen pekar på den direkta proportionaliteten som föreligger mellan hastighetskonstanten hos en reaktion och frekvensen av sammandrabbningarna mellan molekyler.
Även denna ekvation kan representeras på ett mer bekvämt sätt genom att tillämpa egenskapen hos naturliga logaritmer på varje sida av ekvationen, varvid man erhåller:
ln k = ln A - Ea / RT
Vid omordnandet av termerna för att erhålla ekvationen för en rad (y = mx + b) uppnås följande uttryck:
ln k = (- Ea / R) (1 / T) + ln A
Så när vi bygger en graf på ln k mot 1 / T får vi en rak linje där ln representerar y-koordinaten, (- A / R) representerar lutningen av linjen (m), (1 / T) representerar koordinaten x och ln A representerar skärningen med axeln för ordinaten (b).
Som framgår är lutningen som härrör från denna beräkning lika med värdet av -Ea / R. Detta innebär att om det är önskvärt att erhålla värdet av aktiveringsenergin med hjälp av detta uttryck, bör en enkel clearing utföras vilket resulterar i:
Ea = -mR
Här vet vi värdet på m och R är en konstant lika med 8,314 J / K · mol.
Hur påverkar aktiveringsenergin reaktionshastigheten?
När man försöker göra en bild av aktiveringsenergin kan den betraktas som en barriär som inte tillåter en reaktion att inträffa mellan de lägre energimolekylerna.
Som i en vanlig reaktion händer att antalet molekyler som kan reagera är ganska stora, kan hastigheten - och ekvivalent den kinetiska energin hos dessa molekyler - vara mycket variabel.
Det händer ofta att endast en reducerad mängd av alla molekyler uppleva en kollision -Den som har snabbare rörelse- har tillräckligt med kinetisk energi för att övervinna storleken på aktiveringsenergin. Så dessa molekyler är lämpliga och kan vara en del av reaktionen.
Enligt Arrhenius ekvation, det negativa tecknet som föregår förhållandet mellan aktiveringsenergi och produkten av gaskonstanten av den absoluta temperaturen innebär att hastighetskonstanten minskande presents med en ökning av aktiveringsenergi, såväl som en tillväxt när temperaturen ökar.
Exempel på beräkning av aktiveringsenergi
Att beräkna aktiveringsenergin genom att konstruera en kurva, enligt Arrhenius ekvation, måste vara hastighetskonstanterna för sönderdelningsreaktionen av acetaldehyd mättes vid fem olika temperaturer och är önskvärt att bestämma aktiveringsenergin för reaktionen, vilken uttrycks som:
CH3CHO (g) → CH4(g) + CO (g)
Uppgifterna för de fem mätningarna är följande:
k (1 / M1/2· S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700-730-760-790-810
Först, för att lösa detta okänt och bestämma aktiveringsenergin måste vi bygga ett diagram över ln k vs 1 / T (y vs x) för att erhålla en rak linje och höj höjden och hitta värdet av Ea, som förklaras.
Omvandla mätdata enligt Arrhenius ekvation [ln k = (- Ea / R) (1 / T) + ln A] följande värden för y och x, respektive är:
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-1): 1,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Av dessa värden och med hjälp av matematisk beräkning av lutningen - antingen i en dator eller i en kalkylator, med uttrycket m = (Y2-och1) / (X2-X1) eller med den linjära regressionsmetoden-vi får det m = -Ea / R = -2.09 * 104 K. Så:
Ea = (8,314 J / K · mol) (2,09 * 104 K)
= 1,74 * 105 = 1,74 * 102 kJ / mol
För att bestämma andra energier av aktivering genom det grafiska sättet utförs en liknande procedur.
referenser
- Wikipedia. (N.D.). Aktiveringsenergi. Hämtad från en.wikipedia.org
- Chang, R. (2007). Kemi, nionde upplagan. Mexiko: McGraw-Hill.
- Britannica, E. (s.f.). Aktiveringsenergi. Hämtad från britannica.com
- Moore, J.W. och Pearson, R.G. (1961). Kinetik och mekanism. Hämtad från books.google.co.ve
- Kaesche, H. (2003). Korrosion av metaller: Fysikalisk-kemiska principer och aktuella problem. Hämtad från books.google.co.ve


