Cyklohexenstruktur, egenskaper, syntes och användningsområden
den cyklohexen är en alken eller cyklisk olefin vars molekylformel är C6H10. Den består av en färglös vätska, olöslig i vatten och blandbar med många organiska lösningsmedel. Det kännetecknas av att det är brandfarligt och i naturen finns det vanligtvis i koltjära..
Cyklohexen syntetiseras genom partiell hydrogenering av bensen och genom dehydratisering av alkoholcyklohexanol; det vill säga en mer rostig form. Liksom andra cykloalkener genomgår den reaktioner av elektrofil tillsats och med fria radikaler; till exempel halogeneringsreaktionen.
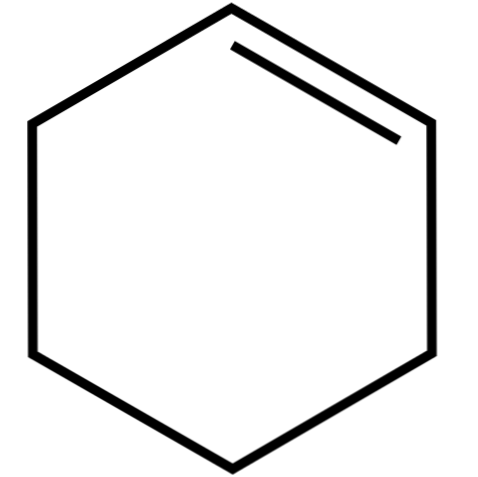
Denna cykliska alken (toppbild) bildar azeotropa blandningar (ej separerbara genom destillation), med lägre alkoholer och ättiksyra. Det är inte särskilt stabilt vid långvarigt förvaring, eftersom det sönderdelas under verkan av solljus och ultraviolett strålning.
Cyklohexen används som ett lösningsmedel och har därför många tillämpningar, såsom: stabilisator av högokta gasoliner och för extraktion av oljor.
Men viktigast, är det att cyklohexen är förmedlaren och råmaterial för framställning av talrika föreningar som är användbara, inklusive: cyklohexanon, adipinsyra, maleinsyra, cyklohexan, butadien, cyklohexylkarboxylsyra, etc..
index
- 1 Strukturen av cyklohexen
- 1.1 Intermolekylära interaktioner
- 2 egenskaper
- 2.1 Kemiska namn
- 2,2 molekylvikt
- 2.3 Fysisk utseende
- 2.4 lukt
- 2,5 kokpunkt
- 2,6 Smältpunkt
- 2,7 flampunkt
- 2,8 Löslighet i vatten
- 2.9 Löslighet i organiska lösningsmedel
- 2,10 Densitet
- 2.11 Ångdensitet
- 2.12 Ångtryck
- 2.13 Automatisk antändning
- 2,14 Nedbrytning
- 2,15 Viskositet
- 2.16 Förbränningsvärme
- 2.17 Förångningsvärme
- 2.18 Ytspänning
- 2,19 Polymerisering
- 2.20 Lukttröskel
- 2.21 brytningsindex
- 2,22 pH
- 2,23 Stabilitet
- 2.24 Reaktioner
- 3 sammanfattning
- 4 användningsområden
- 5 risker
- 6 referenser
Strukturen av cyklohexen
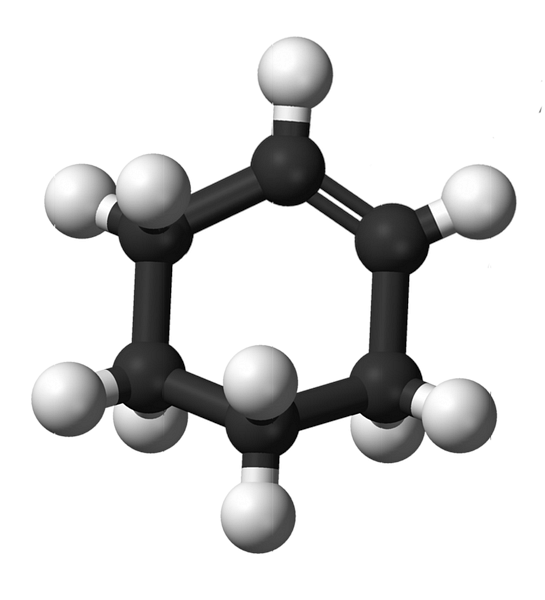
Strukturen av cyklohexen med en modell av sfärer och stänger visas i bilden ovan. Man kan märka de sex kolringarna och dubbelbindningen, båda omättnaderna av föreningen. Ur detta perspektiv verkar det som att ringen är platt; men det är inte alls.
För att börja med har kolatomerna i dubbelbindningen sp-hybridisering2, vilket ger dem en trigonalplan geometri. Därför är dessa två kolatomer och de som ligger intill dem i samma plan; medan de två kolatomerna i den motsatta änden (till dubbelbindningen) är över och under nämnda plan.
Den lägre bilden illustrerar perfekt det som just har förklarats.

Observera att det svarta bandet består av fyra kolatomer: de två av dubbelbindningen och de andra som ligger intill dem. Det exponerade perspektivet är det som skulle erhållas om en åskådare placerade sitt öga precis framför dubbelbindningen. Det kan ses då att ett kol är över och under detta plan.
Eftersom cyklohexenmolekylen inte är statisk kommer de två kolvätena att växla: en kommer att sänka medan den andra kommer att stiga över planet. Så du skulle förvänta dig att molekylen uppför sig.
Intermolekylära interaktioner
Cyklohexen är ett kolväte, och därför är dess intermolekylära interaktioner baserade på dispersionskrafterna i London.
Detta beror på att molekylen är apolär, utan permanent dipolmoment, och dess molekylvikt är den faktor som bidrar mest till att hålla den sammanhängande i vätskan.
Dessutom ökar dubbelbindningen graden av interaktion, eftersom den inte kan röra sig med samma flexibilitet som de andra kolatomerna, och detta gynnar växelverkan mellan närliggande molekyler. Det är av denna anledning att cyklohexen har en något högre kokpunkt (83 ° C) än cyklohexan (81 ° C).
egenskaper
Kemiska namn
Cyklohexen, tetrahydrobensen.
Molekylvikt
82,146 g / mol.
Fysiskt utseende
Färglös vätska.
lukt
Söt lukt.
Kokpunkt
83 ºC till 760 mmHg.
Smältpunkt
-103,5 ºC.
Tändpunkt
-7ºC (sluten kopp).
Löslighet i vatten
Praktiskt taget olöslig (213 mg / L).
Löslighet i organiska lösningsmedel
Blandbar med etanol, bensen, koltetraklorid, petroleumeter och aceton. Det förväntas att det kommer att kunna lösa upp apolära föreningar, som några av allotroperna av kol.
densitet
0,810 g / cm3 vid 20ºC.
Ångdensitet
2,8 (i förhållande till luften lika med 1).
Ångtryck
89 mmHg vid 25ºC.
Självantändning
244 ºC.
sönderdelning
Dekomponerar i närvaro av uransalter, under verkan av solljus och ultraviolett strålning.
viskositet
0,625 mPascal vid 25 ºC.
Förbränningsvärme
3,751,7 kJ / mol vid 25 ° C.
Förångningsvärme
30,46 kJ / mol vid 25 ºC.
Ytspänning
26,26 mN / m.
polymerisation
Det kan polymerisera under vissa förhållanden.
Lukttröskel
0,6 mg / m3.
Brytningsindex
1,4465 vid 20 ºC.
pH
7-8 vid 20ºC.
stabilitet
Cyklohexen är inte särskilt stabil under långvarig lagring. Exponering för ljus och luft kan orsaka produktion av peroxider. På samma sätt är den inkompatibel med starka oxidationsmedel.
reaktioner
-Cykloalkener upplever huvudsakligen tillsatsreaktioner, både elektrofila och fria radikaler.
-Reagerar med brom för att bilda 1,2-dibromcyklohexan.
-Oxiderar snabbt i närvaro av kaliumpermanganat (KMnO4).
-Det kan producera en epoxid (cyklohexenoxid) i närvaro av peroxibensoesyra.
syntes
Cyklohexen framställs genom syrakatalys av cyklohexanol:
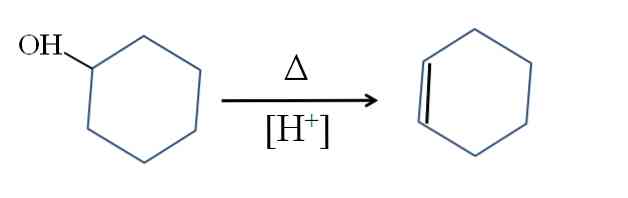
Symbolen A representerar den värme som är nödvändig för att främja utgången av OH-gruppen som en vattenmolekyl i surt medium (-OH2+).
Cyklohexen produceras också genom partiell hydrogenering av bensen; det vill säga två av sina dubbelbindningar lägger till en vätemolekyl:
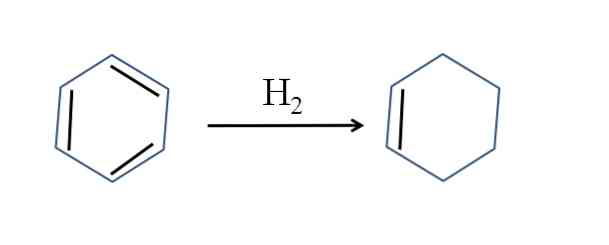
Även om reaktionen verkar enkel, kräver det stora tryck av H2 och katalysatorer.
tillämpningar
-Det har användbarhet som ett organiskt lösningsmedel. Dessutom är det ett råmaterial för framställning av adipinsyra, adipicaldehyd, maleinsyra, cyklohexan och cyklohexylkarboxylsyra.
-Det används vid framställning av cyklohexanklorid, en förening som används som mellanhand vid framställning av farmaceutiska produkter och gummitillsatser..
-Cyklohexen används också vid syntesen av cyklohexanon, råmaterial för produktion av läkemedel, bekämpningsmedel, parfymer och färgämnen.
-Cyklohexen är involverad i syntesen av aminocyklohexanol, en förening som används som ett ytaktivt medel och emulgeringsmedel..
-Dessutom kan cyklohexen användas för framställning i laboratoriet av butadien. Den sistnämnda föreningen används vid tillverkning av syntetiskt gummi vid tillverkning av däck för bilar och används även vid tillverkning av akrylplast.
-Cyklohexen är råmaterialet för syntes av lysin, fenol, polycykloolefinharts och gummitillsatser.
-Den används som en stabilisator av högokta gasoliner.
-Inblandad i syntesen av vattentäta beläggningar, sprickbeständiga filmer och bindande bindemedel för beläggningar.
risker
Cyklohexen är inte en mycket giftig förening, men kan orsaka rodnad av hud och ögon genom kontakt. Inandningen kan ge hosta och dåsighet. Dessutom kan dess intag orsaka sömnighet, andningssvårigheter och illamående.
Cyklohexen absorberas dåligt i mag-tarmkanalen, så ingen allvarlig systemisk effekt förväntas på grund av intag. Den största komplikationen är dess aspiration genom andningsorganen, som kan producera kemisk lunginflammation.
referenser
- Joseph F. Chiang, och Simon Harvey Bauer. (1968). Molekylär struktur av cyklohexen. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyklohexen: Faror, Syntes och Struktur. Study. Hämtad från: study.com
- Morrison, R.T. och Boyd, R.N. (1987). Organisk kemi (5ta Edition.). Redaktionell Addison-Wesley Iberoamericana.
- PubChem. (2019). Cyklohexen. Hämtad från: pubchem.ncbi.nlm.nih.gov
- Kemisk bok. (2019). Cyklohexen. Hämtad från: chemicalbook.com
- Toxikologiska datanätverk. (2017). Cyklohexen. ToxNet. Hämtad från: toxnet.nlm.nih.gov
- Chemoxy. (N.D.). Strukturformeln för cyklohexen är. Hämtad från: chemoxy.com


