Kalorimeterhistoria, delar, typer och deras egenskaper
den kalorimeter är en anordning som används för att mäta temperaturförändringen i en mängd ämne (vanligtvis vatten) med känd specifik värme. Denna temperaturförändring beror på att värmen som absorberas eller frigörs under processen studeras; kemiska om det är en reaktion, eller fysisk om den består av en fas- eller tillståndsändring.
I laboratoriet är den enklaste kalorimetern som kan hittas av kaffekoppen. Det används för att mäta värmen som absorberas eller frigörs i en reaktion vid konstant tryck, i vattenhaltig lösning. Reaktionerna väljs för att undvika intervention av reagenser eller gasformiga produkter.
 I en exoterm reaktion kan mängden värme som frisätts beräknas från ökningen av kalorimeterens temperatur och vattenlösningen:
I en exoterm reaktion kan mängden värme som frisätts beräknas från ökningen av kalorimeterens temperatur och vattenlösningen:
Värme som frigörs i reaktionen = mängd värme absorberad av kalorimetern + mängden värme absorberad av lösningen
Mängden värme som absorberas av kalorimetern kallas kalorimeterns kaloriekapacitet. Detta bestäms genom att tillföra en känd mängd värme till kalorimetern med en given mängd vatten. Därefter mäts temperaturhöjningen av kalorimetern och lösningen den innehåller.
Med dessa data och användningen av vattnets specifika värme (4,18 J / g.ºC) kan kalorimeterns kaloriekapacitet beräknas. Denna kapacitet kallas även kalorimeterns konstant.
Å andra sidan är värmen som uppnås av den vattenhaltiga lösningen lika med m · ce · Δt. I formeln m = vattenmassan, ce = specifik värme av vatten och Δt = temperaturändring. Att veta allt detta kan man sedan beräkna mängden värme som frigörs av den exoterma reaktionen.
index
- 1 Kalorimeterens historia
- 2 delar
- 3 Typer och deras egenskaper
- 3.1 Kaffekoppen
- 3.2 Den kalorimetriska pumpen
- 3.3 Den adiabatiska kalorimetern
- 3.4 Isoperibolisk kalorimeter
- 3.5 Flödeskalorimetern
- 3.6 Kalorimetern för differentialskanningskalorimetri
- 4 applikationer
- 4.1 I fysikekemi
- 4.2 I biologiska system
- 4.3 Kalorimeter för syrepump och kalorikraft
- 5 referenser
Kalorimeterens historia
1780 ansåg A. L. Lavoisier, fransk kemist, en av fäderna av kemi, använde en marsvin för att mäta värmeproduktionen genom hans andning.
Hur? Använda en enhet som liknar en kalorimeter. Värmen som produceras av marsvinet bevisades genom smältning av snön som omringade apparaten.
Forskare A. L Lavoisier (1743-1794) och P. S. Laplace (1749-1827) designade en kalorimeter som användes för att mäta kroppens specifika värme genom metoden att smälta is.
Kalorimetern bestod av en tinpläterad cylindrisk bägare, lackerad, hållen av ett stativ och internt avslutad med en tratt. Inuti placerades ett annat glas, liknande det föregående, med ett rör som gick genom ytterkammaren och som var försedd med en nyckel. Inuti det andra glaset var ett rutnät.
I detta galler placerades varelsen eller föremålet vars specifika värme önskade att bestämma. Is placerades inuti de koncentriska kärlen, precis som i korgen.
Värmen som produceras av kroppen absorberades av isen och orsakade dess fusion. Och den flytande vattenprodukten av isens smältning samlades upp och öppnade nyckeln till det inre glaset.
Och till sist vågade vattnet, den smälta isens massa var känd.
delar
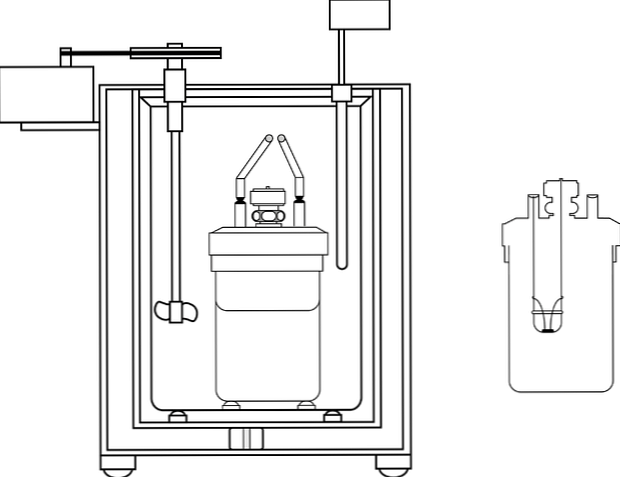
Den vanligaste kalorimetern i kemiundervisningslaboratorier är den så kallade kaffekopkalorimetern. Denna kalorimeter består av en bägare, eller istället en behållare av anime material som har vissa isolerande egenskaper. Inne i denna behållare placeras vattenlösningen med kroppen som kommer att producera eller absorbera värme.
I övre delen av behållaren placeras ett lock av isolerande material med två hål. I en införs en termometer för att mäta temperaturförändringarna och i den andra en omrörare, företrädesvis av glasmaterial, som utför funktionen att flytta innehållet i den vattenhaltiga lösningen.
Bilden visar delarna av en kalorimetrisk pump; Det kan dock observeras att det har termometer och omrörare, vanliga element i flera kalorimetrar.
Typer och deras egenskaper
Kaffekoppen
Det är ett som används vid bestämning av värmen som frigörs av en exoterm reaktion och värmen absorberas i en endoterm reaktion.
Dessutom kan den användas vid bestämning av kroppens specifika värme; det vill säga den mängd värme som ett gram av substansen behöver absorbera för att höja sin temperatur med en grad Celsius. .
Den kalorimetriska pumpen
Det är en anordning där mängden värme som frigörs eller absorberas i en reaktion som uppträder vid konstant volym mäts.
Reaktionen sker i ett starkt stålkärl (pumpen), som nedsänktes i en stor volym vatten. Detta gör förändringarna i vattentemperaturen liten. Därför antas att de förändringar som är förknippade med reaktionen mäts vid konstant temperatur och volym.
Ovanstående indikerar att inget arbete görs när en reaktion utförs i en kalorimetrisk pump.
Reaktionen börjar genom att mata elektricitet genom kablar anslutna till pumpen.
Den adiabatiska kalorimetern
Det kännetecknas av att en isolerande struktur kallas en sköld. Skölden ligger runt cellen där värme och temperatur förändras. Den är också ansluten till ett elektroniskt system som håller sin temperatur mycket nära cellens, för att undvika värmeöverföring.
I en adiabatisk kalorimeter minimeras temperaturskillnaden mellan kalorimetern och dess omgivningar; såväl som att minimera värmeöverföringskoefficienten och tiden för värmeväxling.
Dess delar består av följande:
-Cellen (eller behållaren), integrerad i ett isoleringssystem, genom vilket det försöker undvika värmeförlust.
-Termometern, för att mäta temperaturförändringar.
-En värmare ansluten till en styrbar källa för elektrisk spänning.
-Och skölden, som redan nämnts.
I denna typ av kalorimeter kan egenskaper som entropi, Debye-temperatur och elektronisk tillståndstäthet bestämmas.
Den isoperiboliska kalorimetern
Det är en anordning där reaktionscellen och pumpen är nedsänkta i en struktur som kallas en jacka. I det här fallet består den så kallade jackan av vatten, hålls vid konstant temperatur.
Temperaturen hos cellen och pumpen stiger när värme frigörs under förbränningsprocessen; men temperaturen hos vattenmanteln hålls vid en fast temperatur.
En mikroprocessor styr temperaturen hos cellen och manteln, vilket gör nödvändiga korrigeringar av läckagevärmen som beror på skillnaderna mellan de två temperaturerna.
Dessa korrigeringar tillämpas kontinuerligt och med en slutgiltig korrigering baserad på mätningarna före och efter provet.
Flödeskalorimetern
Utvecklad av Caliendar, den har en anordning för att flytta en gas i en behållare med konstant hastighet. När värme tillsätts uppmäts temperaturförhöjningen i vätskan.
Flödeskalorimetern kännetecknas av:
- En exakt mätning av konstant flödeshastighet.
- Noggrann mätning av mängden värme som införs i vätskan genom en värmare.
- En noggrann mätning av temperaturökningen i gasen som orsakas av energitillförseln
- En konstruktion för mätning av gasens kapacitet under tryck.
Kalorimetern för differentialscanningskalorimetri
Det karakteriseras av att ha två behållare: i det ena är provet som ska studeras placerat, medan det andra hålls tomt eller ett referensmaterial används.
De två kärlen upphettas med konstant energihastighet, med hjälp av två oberoende värmare. När uppvärmningen av de två behållarna börjar, kommer datorn att diagramma skillnaden i värmeflödet hos värmaren mot temperaturen och därigenom kunna bestämma värmeflödet.
Dessutom kan variationen av temperaturen som en funktion av tiden bestämmas; och slutligen kaloriekapaciteten.
tillämpningar
I fysikekemi
-De grundläggande kalorimetrarna, typ kaffekopp, tillåter att mäta mängden värme som en kropp släpper ut eller absorberar. De kan bestämma om en reaktion är exoterm eller endoterm. Dessutom kan en kropps specifika värme bestämmas.
-Med den adiabatiska kalorimetern har det varit möjligt att bestämma entropin hos en kemisk process och den elektroniska tätheten av staten.
I biologiska system
-Mikrokalorimetrar används för att studera biologiska system som innefattar interaktioner mellan molekyler, liksom de molekylära konformationella förändringarna som inträffar; till exempel vid utfällningen av en molekyl. Linjen innehåller både differentialscanning och isotermitrering.
-Mikrokalorimetern används vid utveckling av läkemedel av små molekyler, bioterapeutika och vacciner.
Oxygen pump kalorimeter och kalorisk effekt
Förbränningen av ett flertal ämnen förekommer i syrgaspumpens kalorimeter, och dess kaloriekraft kan bestämmas. Bland de ämnen som studeras genom användningen av denna kalorimeter är: kol och koks; ätliga oljor, både tunga och lätta; bensin och alla motorbränslen.
Samt typerna av bränslen för flygplanreaktorer; bränsleavfall och avfallshantering; livsmedelsprodukter och kosttillskott för mänsklig näring; foderväxter och tillägg för djurfoder byggmaterial; raket och drivmedel.
På samma sätt har kalorikraften bestämts av kalorimetri i termodynamiska studier av brännbara material; i studien av energibalans i ekologi; i sprängämnen och termiska pulver och i undervisningen av grundläggande termodynamiska metoder.
referenser
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan). CENGAGE Learning.
- González J., Cortés L. & Sánchez A. (s.f.). Adiabatisk kalorimetri och dess tillämpningar. Återställd från: cenam.mx
- Wikipedia. (2018). Kalorimeter. Hämtad från: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22 juni 2018). Kalorimeterdefinition i kemi. Hämtad från: thoughtco.com
- Gillespie, Claire. (11 april 2018). Hur fungerar en kalorimeter? Sciencing. Hämtad från: sciencing.com


