Trophoblast funktioner, lager och utveckling
den trofoblast är en struktur som består av en uppsättning celler som bildar det yttre skiktet som omger en blastocyst, i tidiga stadier av embryonal utveckling av däggdjur. Termen kommer från grekiska trofos, vilket betyder "matning" och av I blast, som hänför sig till den embryonala bakteriecellen.
Under de tidiga stadierna av graviditeten hos de placentala däggdjuren är trofoblastcellerna de första som skiljer sig i en äggstock som har befruktats. Denna uppsättning celler är känd som trofoblast, men efter gastrulering kallas de trophoectoderm.
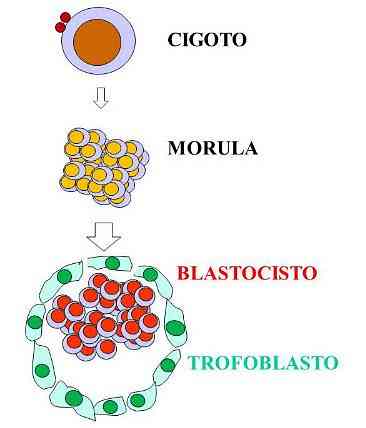
Trofoblasten ger näringsmässiga molekyler till det utvecklande embryot och underlättar dess implantering till livmodern på grund av dess förmåga att erodera livmoderns vävnader. Blastocysten kan således anslutas till kaviteten som bildas av livmoderväggen, där den kommer att absorbera näringsämnena från vätskan som kommer från moderen.
index
- 1 Funktioner
- 2 lager
- 2.1 Sincitiotrophoblast
- 2,2 Citotrophoblast
- 3 utveckling
- 4 referenser
funktioner
Trofoblast spelar en avgörande roll vid implantering och placentation. Båda processerna uppträder korrekt som en följd av molekylär kommunikation mellan fostrets och moderns vävnader, medierade av hormoner och membranreceptorer.
Under implanteringen av blastocysten skapas nya typer av olika trofoblastceller, som kallas villösa och extravillösa trofoblaster. Den förstnämnda deltar i utbytet mellan fostret och moderen, och den senare kopplar placenta kroppen till livmoderns vägg.
Å andra sidan kännetecknas placentationen av invasionen av livmoderna spiralartärer av extravellosus trofoblastceller som uppkommer genom förankringen av villi. På grund av denna invasion, ersätts den arteriella strukturen med amorffibrinoidmaterial och endovaskulära trofoblastiska celler..
Denna transformation etablerar ett perfusionssystem med låg kapacitet och hög kapacitet från de radiella artärerna till det intervallutrymme, där det håriga trädet är inbäddat.
Graviditetens fysiologi beror på den ordnade utvecklingen av strukturella och funktionella förändringar av den villösa och extravillösa trofoblasten.
Detta innebär att en störning av sådana processer kan leda till olika typer av komplikationer av varierande grad av svårighetsgrad, inklusive eventuell förlust av graviditet och dödliga sjukdomar.
Trofoblasten, även om den inte direkt bidrar till bildandet av embryot, är en föregångare till moderkroppen, vars funktion är att upprätta en förbindelse med moderns livmoder för att möjliggöra näring av det utvecklande embryot. Trofoblasten är uppenbar från dag 6 i humana embryon.
skikt
Under implantationen växer trofoblasten multiplicerande och skiljer sig i två skikt:
sincitiotrofoblasto
Syncytiotrophoblast är det yttersta lagret av trofoblast, dess celler har inte intercellulära gränser eftersom deras membran har gått vilse (syncytium). Av denna anledning observeras cellerna som multinucleaterade och bildar ledningar som infiltrerar endometriumet..
Cellerna i syncytiotrophoblast kommer från fusionen av cellerna i cytotrofoblasten och deras tillväxt orsakar alstring av chorioniska villi. Dessa tjänar till att öka ytan som tillåter flödet av näringsämnen från moderen till fostret.
Genom apoptos (programmerad celldöd) av livmoderstromcellerna skapas utrymmen genom vilka blastocyten tränger in mer i endometriumet.
Slutligen produceras hormonet humant koriongonadotropin (HCG) i syncytiotrophoblast som detekteras efter den andra veckan av graviditeten..
cytotrofoblastceller
För sin del bildar cytotrofoblasten det innersta lagret av trofoblasten. I grund och botten är det ett oregelbundet lager av ovoidceller med en enda kärna och det är därför de kallas mononukleära celler.
Cytotrofoblasten ligger strax under syncytiotrofoblasten och dess utveckling börjar från den första veckan av graviditeten. Trofoblast underlättar embryoimplantation genom cytotrofoblastceller, vilka har förmågan att differentiera i olika vävnader.
Korrekt utveckling av cytotrofoblastceller är avgörande för framgångsrikt implantation av embryot till livmoderendometrium och är en högreglerad process. Den okontrollerade tillväxten av dessa celler kan emellertid generera tumörer, såsom kororiokarcinom..
utveckling
Under den tredje veckan innefattar processen med embryonisk utveckling även den fortsatta utvecklingen av trofoblasten. Ursprungligen bildas den primära villi av den inre cytotrofoblasten omgiven av det yttre skiktet av syncytiotrofoblast.
Därefter migrerar cellerna i den embryonala mesodermen mot den primära villuskärnan och detta inträffar under den tredje veckan av dräktighet. I slutet av denna vecka börjar dessa mesodermala celler att singulera för att bilda blodkärlsceller.
Eftersom denna process av celldifferentiering fortskrider, kommer det som är känt som det hårvillösa systemet att bildas. Vid denna tidpunkt är placental villi bildad, vilket kommer att bli finalen.
De kapillärer som bildas från denna process kommer senare att komma i kontakt med andra kapillärer som bildas samtidigt i mesodermen hos korionplattan och fixeringspediklet..
Dessa nybildade kärl kommer att komma i kontakt med de i det intraembryoniska cirkulationssystemet. Således, i det ögonblick då hjärtat börjar slå (detta sker i den fjärde veckan av utveckling) är det vilosystemet redo att leverera syre och näringsämnen som är nödvändiga för dess tillväxt.
Fortsatt med utvecklingen tränger cytotrofoblasten ännu mer i syncytiotrophoblast som täcker håret tills det når mödrets endometrium. De kommer i kontakt med några håriga stammar och bildar det yttre cytotrofoblastiska täcket.
Detta skikt går runt trofoblasten och slutar fast ansluta till chorionplattan till endometriala vävnaden vid slutet av den tredje veckan (dagar 19-20) av graviditeten..
Medan chorionhålan har förstorats, är embryot förankrat till dess trofoblastiska täckning av fixeringspedikan, en ganska smal kopplingsstruktur. Därefter blir fixeringspedalen navelsträngen som kommer att binda placentan till embryot.
referenser
- Cross, J.C. (1996). Trofoblastfunktion vid normal och preeklamptisk graviditet. Foster- och modermedicinsk granskning, 8(02), 57.
- Lunghi, L., Ferretti, M.E., Medici, S., Biondi, C., & Vesce, F. (2007). Kontroll av humant trofoblastfunktion. Reproduktiv biologi och endokrinologi, 5, 1-14.
- Pfeffer, P. L., & Pearton, D.J. (2012). Trofoblastutveckling. reproduktion, 143(3), 231-246.
- Röd-Horse, K., Zhou, Y., Genbacev, O., Prakobphol, A., Foulk, R., McMaster, M., & Fisher, S.J. (2004). Trofoblastdifferentiering under embryoimplantation och bildning av moder-fetalt gränssnitt. Journal of Clinical Investigation, 114(6), 744-754.
- Screen, M., Dean, W., Cross, J.C., & Hemberger, M. (2008). Cathepsinproteaser har olika roller i trofoblastfunktion och vaskulär remodeling. utveckling, 135(19), 3311-3320.
- Staun-Ram, E., & Shalev, E. (2005). Humant trofoblastfunktion under implantationsprocessen. Reproduktiv biologi och endokrinologi, 3(Figur 2), 1-12.
- Velicky, P., Knöfler, M., & Pollheimer, J. (2016). Funktion och kontroll av humana invasiva trofoblast-subtyper: Intrinsic vs. mammakontroll. Celladhesion och migrering, 10(1-2), 154-162.


